
分析 (1)根据化学式改写成相应的氧化物得形式,按照活泼金属氧化物•较活泼金属氧化物•SiO2•H2O得顺序来书写,并要遵守原子守恒来分析解答;
(2)明矾中铝离子水解生成胶体具有吸附性,则可对水质净化.
解答 解:(1)铝的氧化物为Al2O3,硅的氧化物为SiO2,氢的氧化物为H2O,
则根据活泼金属氧化物.较活泼金属氧化物.SiO2.H2O得顺序可知,
[Al2Si2O5(OH)4]可改成Al2O3•2SiO2•2H2O,
故答案为:Al2O3•2SiO2•2H2O;
(2)明矾中铝离子水解生成胶体具有吸附性,则可对水质净化,水解离子反应为A13++3H2O?Al(OH)3(胶体)+3H+,
故答案为:A13++3H2O?Al(OH)3(胶体)+3H+.
点评 本题考查将复杂化合物写出氧化物的形式、方程式是书写,明确物质的性质是解本题关键,根据反应物、生成物及反应条件书写方程式,题目难度不大.


科目:高中化学 来源: 题型:解答题
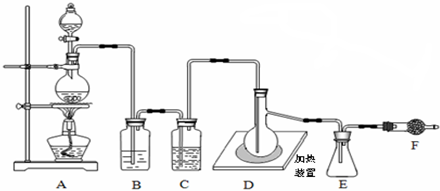
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下表中各组物质之间通过一步反应不可能实现如图所示转化关系的是( )
下表中各组物质之间通过一步反应不可能实现如图所示转化关系的是( )| 选项 | X | Y | Z |
| A | Mg | MgO | MgCl2 |
| B | Fe | FeCl3 | FeCl2 |
| C | Na2CO3 | NaOH | NaHCO3 |
| D | Cl2 | Ca(ClO)2 | HClO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力实施矿物燃料“脱硫、脱销技术”,减少硫的氧化物和氮的氧化物污染 | |
| B. | 禁止未经处理的工业废水和生活污水的任意排放 | |
| C. | 积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用 | |
| D. | 大量使用化肥农药,提高粮食产量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2(FeCl3) | B. | KCl(NaCl) | C. | Fe2O3(Al2O3) | D. | NaCl(MgCl2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定时间/小时钟 | 0 | 1 | 2 | 4 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |
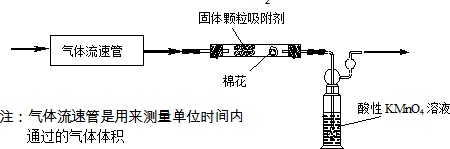
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16 | B. | 35 | C. | 19 | D. | 51 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大理石与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 铜和硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| C. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 硫酸与氢氧化钡溶液反应:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2000kJ | B. | △H=-2000kJ/mol | C. | △H=-1500kJ/mol | D. | -2000kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com