
可逆反应aA(g) + bB(g) 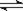 cC(g) + dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是
cC(g) + dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是
| A.达平衡后,若升温,平衡左移 |
| B.达平衡后,加入催化剂则C%增大 |
| C.化学方程式中a+b>c+d |
| D.达平衡后,减少A的量有利于平衡向右移动 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
700℃时,向容积为1 L的密闭容器中充入一定量的CO2和H2,发生反应:CO2+H2(g)  CO(g)+H2O(g) 反应过程中测定的部分数据见下表(表中t2>t1):
CO(g)+H2O(g) 反应过程中测定的部分数据见下表(表中t2>t1):
| 反应时间/min | n(CO2)/mol | H2/ mol |
| 0 | 1.50 | 1.00 |
| t1 | | 0.40 |
| t2 | 0.90 | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
近年来,由于温室效应和资源短缺等问题,关于CO2和碳酸盐应用的研究受到人们的重视。某研究小组利用反应:CO(g)+H2O(g) H2(g)+CO2(g) ΔH="-41.2" kJ/mol制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
H2(g)+CO2(g) ΔH="-41.2" kJ/mol制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
(1)已知:850 ℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图所示: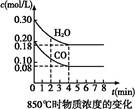
下列说法正确的是 (填序号)。
| A.达到平衡时,氢气的物质的量是0.12 mol |
| B.达到平衡时,反应体系最终会放出49.44 kJ热量 |
| C.第4 min时,混合气体的平均相对分子质量不再变化 |
| D.第6 min时,若升高温度,反应平衡常数会减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
反应CO+H2O(g) CO2+H2在724℃达到平衡时,分别改变下列条件,K值发生变化的是
CO2+H2在724℃达到平衡时,分别改变下列条件,K值发生变化的是
| A.将压强减小至原来的一半 | B.将反应温度升高 |
| C.添加催化剂 | D.增大水蒸气的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
图甲、图乙分别表示反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0 在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,下列说法正确的是( )
CO(g)+H2O(g) ΔH>0 在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,下列说法正确的是( )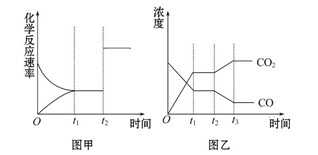
| A.图甲中t2时刻发生改变的条件是增大反应物的浓度 |
| B.图甲中t2时刻发生改变的条件可能是增大压强 |
| C.图乙中t2时刻发生改变的条件是升高温度 |
| D.图乙中t2时刻发生改变的条件是从体系中分离出水蒸气 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I3-(aq)。测得不同温度下该反应的平衡常数K如表所示:
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1 100 | 841 | 689 | 533 | 409 |
 I3-(aq)的ΔH>0
I3-(aq)的ΔH>0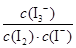
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
纳米钴(Co)常用于CO加氢反应的催化剂,500 K时有催化反应:CO(g)+3H2(g) CH4(g)+H2O(g) ΔH<0。下列有关说法正确的是( )
CH4(g)+H2O(g) ΔH<0。下列有关说法正确的是( )
| A.纳米技术的应用,提高了催化剂的催化性能 |
| B.缩小容器体积,平衡向正反应方向移动,CO的浓度减小 |
| C.温度越低,越有利于CO催化加氢 |
| D.从平衡体系中分离出H2O(g)能加快正反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,反应过程如图:
2NH3(g) ΔH<0,反应过程如图: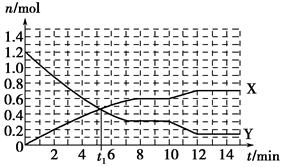
下列说法正确的是( )。
| A.t1 min时正、逆反应速率相等 |
| B.X曲线表示NH3的物质的量随时间变化的关系 |
C.0~8 min,H2的平均反应速率v(H2)=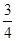 mol·L-1·min-1 mol·L-1·min-1 |
| D.10~12 min,升高温度使反应速率加快,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
可逆反应mA(g)+nB pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是( )。
pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是( )。
A.若增加B的量,平衡体系颜色加深,说明B必是气体
B.增大压强,平衡不移动,说明m+n一定等于p+q
C.升高温度,A的转化率减小,说明正反应是吸热反应
D.若B是气体,增大A的量,A、B的转化率都增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com