
(16分)碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液,生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g)+ CH3OCOOCH3(g) 2 CH3OCOOC2H5(g) ΔH1
2 CH3OCOOC2H5(g) ΔH1
(1)其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比(R)的关系如图所示。
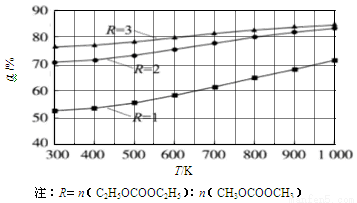
①ΔH1______0(填“<”、“=”或“>”)。
②由图可知,为了提高CH3OCOOCH3的平衡转化率,除了升温,另一措施是___________。
③在密闭容器中,将1mol C2H5OCOOC2H5和1mol CH3OCOOCH3混合加热到650K,利用图中的数据,求此温度下该反应的平衡常数K(请写出计算过程)。
(2)已知:CH3OCOOCH3(g) + C2H5OH(g) CH3OCOOC2H5(g) + CH3OH(g) ΔH2
CH3OCOOC2H5(g) + CH3OH(g) ΔH2
CH3OCOOC2H5(g) + C2H5OH(g) C2H5OCOOC2H5(g) + CH3OH(g) ΔH3
C2H5OCOOC2H5(g) + CH3OH(g) ΔH3
ΔH1=____________________(用ΔH2和ΔH3表示)
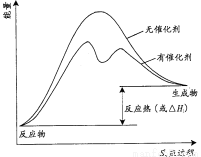
(3)已知上述反应需要催化剂,请在答题卡的坐标图中,画出有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(1)① >(2分)② 增大反应物中C2H5OCOOC2H5的浓度(或比例)(2分)
③由图知,平衡时CH3OCOOCH3的转化率为60%。(1分)
设容器的容积为V(L)
C2H5OCOOC2H5(g)+ CH3OCOOCH3(g) 2CH3OCOOC2H5(g)
2CH3OCOOC2H5(g)
初始浓度/ mol·L-1: 1/V 1/V 0
平衡浓度/ mol·L-1: 0.4/V 0.4/V 1.2/V (2分)
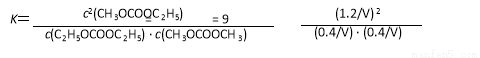
 (3分)
(3分)
(2)ΔH2-ΔH3(3分) (3)(3分)
【解析】
试题分析:(1)①根据图像变化可知,在反应物配比相同的条件下,温度越高,CH3OCOOCH3的平衡转化率越大,这说明升高温度平衡向正反应方向进行,因此该反应的正反应为吸热反应,即△H>0;
②根据图像变化可知,在温度相同的条件下,R越大,CH3OCOOCH3的平衡转化率越大,因此除升温外,还可增大反应物中C2H5OCOOC2H5的浓度(或比例);
③由图知,R=1,650K,达到平衡时CH3OCOOCH3的转化率为60%。设容器的容积为V(L),则
C2H5OCOOC2H5(g)+ CH3OCOOCH3(g) 2CH3OCOOC2H5(g)
2CH3OCOOC2H5(g)
初始浓度/ mol·L-1: 1/V 1/V 0
平衡浓度/ mol·L-1: 0.4/V 0.4/V 1.2/V
所以该温度下平衡常数K=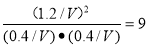
(2)已知①CH3OCOOCH3(g)+C2H5OH(g) CH3OCOOC2H5(g)+CH3OH(g)△H2,②CH3OCOOC2H5(g)+C2H5OH(g)
CH3OCOOC2H5(g)+CH3OH(g)△H2,②CH3OCOOC2H5(g)+C2H5OH(g) C2H5OCOOC2H5(g)+CH3OH(g)△H3,则根据盖斯定律可知,①-②可得C2H5OCOOC2H5(g)+CH3OCOOCH3(g)
C2H5OCOOC2H5(g)+CH3OH(g)△H3,则根据盖斯定律可知,①-②可得C2H5OCOOC2H5(g)+CH3OCOOCH3(g) 2CH3OCOOC2H5(g),所以反应热△H1=△H2-△H3;
2CH3OCOOC2H5(g),所以反应热△H1=△H2-△H3;
(3)催化剂不影响平衡状态和反应热,但催化剂降低反应所需的活化能,即可反应速率,因此有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图可表示为
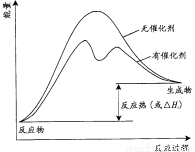 。
。
考点:考查外界条件对平衡状态的影响、化学平衡图像分析以及平衡状态和反应热的有关计算等


科目:高中化学 来源:2014-2015学年福建省高三第一次月考化学试卷(解析版) 题型:选择题
化学与生活是紧密相联的,下列说法正确的是
A.地震灾区用漂白粉消毒,是利用漂白粉溶液的碱性
B.鱼、肉、鸡蛋等富含蛋白质的食品被称为碱性食品,长期缺乏可使尿液偏酸性
C.小苏打的主要成分是碳酸钠
D.实验室储存的镁条着火时,不可以用泡沫灭火器灭火
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三12月月考化学试卷(解析版) 题型:选择题
只由两种元素组成的化合物,其中一种元素是氢元素,这类化合物称氢化物。下列物质不属于氢化物的是
A.H2O B.NaH C.H2SO4 D.NH3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省保定市高三12月联考化学试卷(解析版) 题型:选择题
下列各组离子在指定溶液中,能大量共存的是
A.含有NaClO的溶液中:K+,NH4+, Fe3+,Br-,SO32-
B.所含溶质为Na2S2O3的溶液:K+、SO42-、NO3-、H+
C.加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl-,K+,SO42-
D.使甲基橙变红的溶液中:Fe2+,MnO4-,Na+,SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省保定市高三12月联考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA
B.常温常压下,44 g C3H8中含有的碳碳单键数为3 NA
C.标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数为3 NA
D.1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省广州市高三上学期期中理综化学试卷(解析版) 题型:选择题
常温下,0.1 mol·L-1的一元酸HA与0.1 mol·L-1的NaOH溶液等体积混合后,所得溶液pH>7,下列说法正确的是
A.混合前一元酸HA的c(H+)=0.1 mol·L-1
B.该混合溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
C.HA在水溶液中的电离方程式:HA = H+ + A-
D.该混合溶液中:c(A-)+ c(HA)=0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高三11月月考化学试卷(解析版) 题型:实验题
(19分)某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
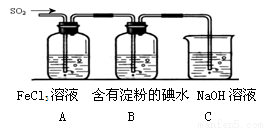
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在 中,再加水稀释,这样操作的目的是 。
(2)装置C的作用是 。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、 、自然干燥,在这一系列操作中没有用到的仪器有 (填序号)。
A.蒸发皿
B.石棉网
C.漏斗
D.烧杯
E.玻璃棒
F.坩埚
(4)根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式 ;
②请设计实验方案检验有Fe2+生成 ;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42—。该做法 (填“合理”或“不合理”),理由是 。
(5)能表明I-的还原性弱于SO2的现象是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:填空题
下列物质:①石墨②三氧化硫③HNO3④熔融的硫酸钡⑤NaOH固体⑥冰醋酸⑦NH3·H2O⑧胆矾
(1)其中属于强电解质的是 (填编号)。
(2)将②③⑥三种物质溶于水,配得pH相同的溶液。设三种溶液的物质的量浓度依次为c1、c2、c3,则三者物质的量浓度由大到小的顺序为 ;取等体积等pH的上述三种溶液,分别加入足量锌粉,反应过程中放出H2的速率依次为v1、v2、v3,其大小关系为 。
(3)某温度时,测得0.01 mol·L-1的NaOH的pH=13,该温度下水的离子积常数Kw = 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高一上学期期中化学试卷(解析版) 题型:选择题
某工厂排出的废液中含有Ba2+、Ag+、Cu2+,用①Na2CO3溶液,②NaOH溶液,
③盐酸三种试剂将它们逐一沉淀并加以分离,加入试剂的正确顺序是
A.②③① B.③②① C.①②③ D.③①②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com