
分析 取5.12gCu,物质的量是0.08mol,根据铜元素守恒,Cu最终完全转化为CuCl2•2H2O晶体,质量是13.68g,完全转化为 Cu(NO3)2•3H2O晶体,质量是19.36g,反应后溶液有中水54.32g,再经水浴保温蒸发掉42g,得到的饱和溶液中含有水22.32g,根据溶解度的概念进行计算即可.
解答 解:物质混合后发生反应的表达式为:Cu+NO3-+H+=Cu2++H2O+NOx↑,根据20℃溶解度:CuCl2•2H2O 73g/100gH2O,Cu(NO3)2•3H2O,125g/100gH2O,所以Cu(NO3)2•3H2O得溶解度大,硝酸根离子的剩余量很小,所以析出的是CuCl2晶体,取5.12gCu,物质的量是$\frac{5.12g}{64g/mol}$=0.08mol,根据铜元素守恒,生成的氯化铜质量是5.12×$\frac{135}{64}$=10.8g,反应后溶液有水54.32g,再经水浴保温蒸发掉42g,得到的饱和溶液中含有水12.32g,设析出的晶体中含有氯化铜的质量是S,则$\frac{73×\frac{135}{171}}{100g+73×\frac{36}{171}}$=$\frac{S}{100g}$,得S=50g,设最终得到的晶体的化学式为:CuCl2•xH2O,所以$\frac{10.8-8.12×\frac{135}{135+18x}}{12.32-8.12×\frac{18x}{135+18x}}$=$\frac{50.0}{100}$,解得x=3,所以析出的是CuCl2•3H2O.
答:晶体的化学式为:CuCl2•3H2O.
点评 本题考查学生溶解度的计算以及物质的分子式的确定知识,属于综合计算题目,注意元素守恒的应用,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | HCHO CH3COOH | B. | HCOOCH3 CH3COOH | ||
| C. | C2H4 C2H5OH | D. | CH3OH C10H8O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的原子量逐渐增大 | B. | 核外电子排布呈周期性变化 | ||
| C. | 核电荷数逐渐增大 | D. | 元素化合价呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
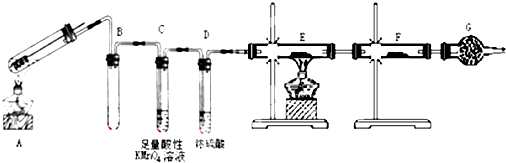
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在进行中和滴定时,用标准酸溶液润洗酸式滴定管2~3次,用蒸馏水洗2~3次,效果更佳 | |
| B. | 基于硫代硫酸钠与稀硫酸反应生成S和SO2,在定量分析测定反应速率时,即可用S对标记遮盖发,也可用排水法测SO2体积,计算出相关的反应速率 | |
| C. | 燃料电池的制作:用包有薄海绵的两根碳棒做电极电解NaSO4溶液,一段时间后切断电源,在两极之间接上发光二极管,发现二极管发光 | |
| D. | 过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离混合物的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
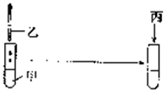 下列实验操作能达到实验目的是(必要时可加热)( )
下列实验操作能达到实验目的是(必要时可加热)( )| 甲 | 乙 | 丙 | 实验目的 | |
| A | 2mL10%的NaOH溶液 | 4-6滴2%的CuSO4溶液 | 0.5mL葡萄糖溶液 | 验证葡萄糖具有氧化性 |
| B | 2mL0.1mol/LAgNO3溶液 | 3滴0.1mol/LNaCl溶液 | 3滴0.1mol/LNaI溶液 | 验证AgCl可转化为溶解度更小的AgI |
| C | FeCl3溶液 | KSCN溶液 | 少量KCl固体 | 验证浓度对化学平衡的影响 |
| D | 3mL无水乙醇 | 2mL乙酸 | 2ml浓硫酸 | 配制反应液以制备乙酸乙酯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验①说明Na2S2O3溶液中水电离的c(OH-)=l0-8 mol.L-l | |
| B. | Na2S2O3溶液pH=8的原因用离子方程式表示为S2O32-+2H2O?Na2S2O3+2OH- | |
| C. | 生成的沉淀B可能是BaSO3或BaSO4,要进一步确认还需再加入稀硝酸验证 | |
| D. | 实验②说明Na2S2O3具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
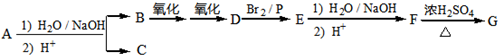
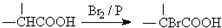
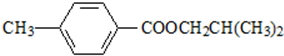 .
.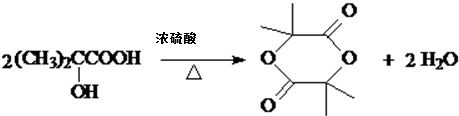 ,该反应属于取代反应(或酯化反应)(填反应类型).
,该反应属于取代反应(或酯化反应)(填反应类型).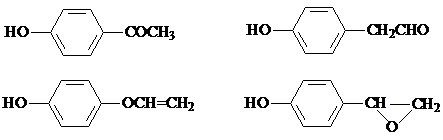 .
.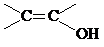 )结构.
)结构.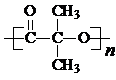 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com