
| A. | 可能是纯净物也可能是混合物 | B. | 一定是一种化合物 | ||
| C. | 一定是纯净物 | D. | 一定是一种单质 |
 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:解答题
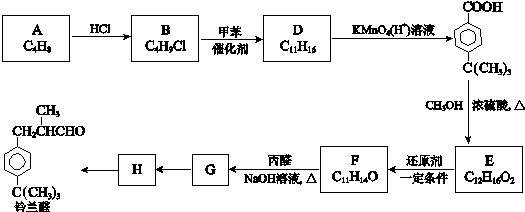
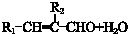
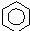 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ 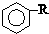 +HCl
+HCl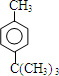 .
. .
.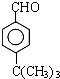 .
.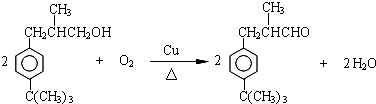 .
.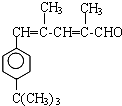 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10s内,X的平均反应速率为0.025 mol•L-1•s-1 | |
| B. | 第10s时,Y的反应速率为0.075 mol•L-1•s-1 | |
| C. | 第10s时,X为 1.5 mol,Y的浓度为0.25 mol•L-1 | |
| D. | 10s内,X和Y反应放出的热量为a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、Cl-、SO32- | B. | K+、Na+、NO3-、SO42- | ||
| C. | K+、NH4+、NO3-、SO42- | D. | K+、Mg2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
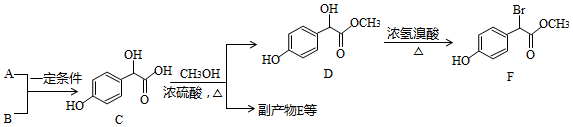
 .
.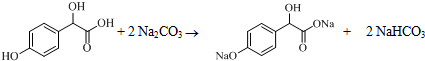 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol丙烯酸中含有双键的数目为0.1NA | |
| B. | 1mol/L FeCl3溶液中,阴、阳离子总数大于0.4NA | |
| C. | 12g金刚石中所含的C-C键数为2NA | |
| D. | 18g的D2O与NA个CH3-具有相同的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐既可以做调味剂,又可以做防腐剂 | |
| B. | 纯碱既可以做清洗品,又可以做发酵粉 | |
| C. | 漂白粉既可以做消毒剂,又可以做漂白剂 | |
| D. | 酒精既可以做饮料,又可以做燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉或漂粉精长期暴露在空气中会变质:Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO 2HClO=2 HCl+O2↑ | |
| B. | FeCl3溶液中加入铁粉,震荡后滴入几滴KSCN溶液,未见溶液变红:2Fe3++Fe═3 Fe2+ | |
| C. | 把水加入盛有过氧化钠固体的试管中,放出气体,可使带火星的木条复燃:2Na2O2+2 H2O═4 NaOH+O2↑ | |
| D. | 溶质物质的量之比为1:2的明矾溶液与 Ba(OH)2溶液混合,生成白色沉淀:Al3++2SO42-+2Ba2++4 OH-═2 BaSO4↓+Al(OH)3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
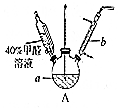 甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发.为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究.
甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发.为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究.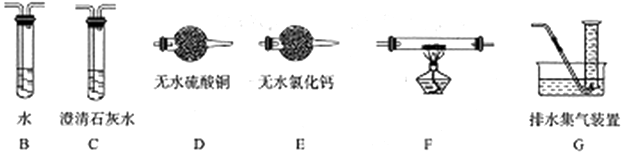
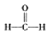 $\stackrel{被氧化}{→}$
$\stackrel{被氧化}{→}$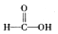 $\stackrel{被氧化}{→}$
$\stackrel{被氧化}{→}$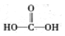 .设计实验证明a中甲醛的碳元素未被氧化成+4价.
.设计实验证明a中甲醛的碳元素未被氧化成+4价.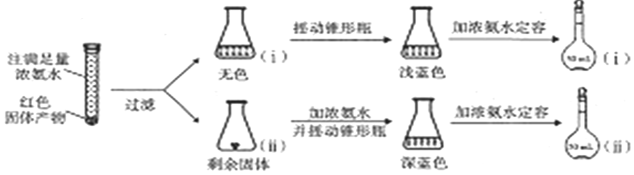
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com