

| A. | E2+的氧化性比M2+的氧化性强 | |
| B. | 在③反应中若不加稀硫酸可能看到红褐色沉淀 | |
| C. | 反应④的离子方程式可表示为:E3++3SCN-?E(SCN)3↓ | |
| D. | 在反应①中只能用浓硫酸,既表现了酸性、又表现了氧化性 |
分析 红色金属M为Cu,与硫酸、双氧水反应得到蓝色溶液为CuSO4,金属E与硫酸铜反应得到Cu与X,X与硫酸、过氧化氢反应得到Y,Y与氨水得到红褐色沉淀Z、与KSCN溶液反应得红色溶液,则Y含有Fe3+,则E为Fe,X为FeSO4,Y为Fe2(SO4)3,Z为Fe(OH)3.
解答 解:红色金属M为Cu,与硫酸、双氧水反应得到蓝色溶液为CuSO4,金属E与硫酸铜反应得到Cu与X,X与硫酸、过氧化氢反应得到Y,Y与氨水得到红褐色沉淀Z、与KSCN溶液反应得红色溶液,则Y含有Fe3+,则E为Fe,X为FeSO4,Y为Fe2(SO4)3,Z为Fe(OH)3.
A.Fe2+的氧化性比Cu2+的氧化性弱,故A错误;
B.在③反应中若不加稀硫酸,硫酸亚铁被过氧化氢氧化为硫酸铁,在酸性溶液中铁离子会沉淀,可能看到红褐色沉淀,故B正确;
C.反应④的离子方程式可表示为:Fe3++3SCN-═Fe(SCN)3,没有沉淀生成,故C错误;
D.在反应①中只用浓硫酸,发生反应:Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,反应中硫酸既表现了酸性,又表现了氧化性,故D正确,
故选BD.
点评 本题考查无机物推断,充分利用物质的颜色进行推断,需要学生熟练掌握元素化合物性质,题目难度中等.


科目:高中化学 来源: 题型:实验题
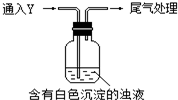 某校探究性活动小组的同学对Na2SO3与AgNO3在不同的pH条件下的反应原理进行实验探究,请你一起参与探究活动并回答有关问题:
某校探究性活动小组的同学对Na2SO3与AgNO3在不同的pH条件下的反应原理进行实验探究,请你一起参与探究活动并回答有关问题:| 实验 | pH | 实 验 现 象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
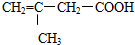 的结构,它不可能发生的反应是( )
的结构,它不可能发生的反应是( )| A. | 与银氨溶液反应析出银 | |
| B. | 使溴的四氯化碳溶液褪色 | |
| C. | 与乙醇在浓硫酸催化下发生酯化反应 | |
| D. | 与新制氢氧化铜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0mol•L-1盐酸的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 20.00 | 0.00 | 22.20 |
| 第二次 | 20.00 | 1.56 | 25.50 |
| 第三次 | 20.00 | 0.22 | 22.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:
油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能 | I1 | I2 | I3 | I4 | … |
| Im/kJ•mol-1 | 578 | 1817 | 2745 | 11578 | … |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 0.9×10-3 | 2.7×10-3 | 8.1×10-3 |
| t2 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
| t3 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com