
某反应过程能量变化如图所示,下列说法正确的是

A.反应过程a有催化剂参与
B.该反应为放热反应,热效应等于ΔH
C.改变催化剂,可改变该反应的活化能
D.有催化剂条件下,反应的活化能等于E1+E2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列叙述错误的是( )
A.某溶液中加入Ba( NO3)2溶液和稀盐酸(过量)析出白色沉淀,则溶液中一定含SO42一.
B.硫酸加入漂白粉中能生成氯气,可用排饱和食盐水法收集
C.NaOH溶液不能保存在带胶头滴管的试剂瓶中,因为NaOH与磨口处的SiO2反应生成Na2SiO3形成粘结
D.可用热的饱和碳酸钠溶液除去金属表面的植物油
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
| 元素 | 相 关 信 息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
(1)W位于元素周期表第 周期第 族;W的原子半径比X的 (填“大”或“小”)。
(2)Z的第一电离能比W的 (填“大”或“小”); XY2由固态变为气态所需克服的微粒间作用力是 ;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称 。
(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是
;W的单质与氢氟酸反应生 成两种无色气体,该反应的化学方程式是 。
成两种无色气体,该反应的化学方程式是 。
(4)在25℃、101Kpa下,已知13.5g的Z固体单质在Y2气体中完全燃烧后恢复至原状态,放热419KJ,该反应的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。

请回答下列问题:
(1)图中A、C分别表示________、________,E的大小对该反应的反应热有无影响?________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________,理由是____________________________;
(2)图中ΔH=________kJ·mol-1;
(3)V2O5的催化循环机 理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:_____________________________________________;
理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:_____________________________________________;
(4)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 mol SO3(g)的ΔH(要求计算过程)。(已知燃烧热是指25 ℃、101 kPa时,1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量)
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为 △H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)
△H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s) 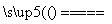 CuSO4(s)+5H2O(l), 热效应为△H3。则下列判断正确的是
CuSO4(s)+5H2O(l), 热效应为△H3。则下列判断正确的是
A.△H2>△H3 B.△H1<△H3
C.△H1+△H3 =△H2 D.△H1+△H2 >△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是( )
A.反应NH3(g)+HCl(g)=== NH 4Cl(s)在室温下可自发进行,则该反应的△H<0
4Cl(s)在室温下可自发进行,则该反应的△H<0
B.电解法精炼铜时,以粗铜作阴极,纯铜作阳极
C.CH3COOH 溶液加水稀释后,溶液中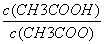 的值减小
的值减小
D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+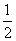 O
O 2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是 ( )。
A.CH3OH转变成H2的过程一定要吸收能量
B.①反应中,反应物的总能量高于生成物总能量
C.根据②推知反应:CH3OH(l)+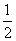 O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
D.反应②中的能量变化如下图所示
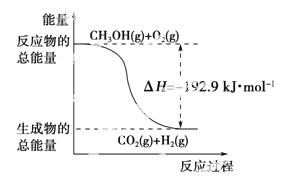
查看答案和解析>>
科目:高中化学 来源: 题型:
在探究氯水成分的实验中,下列根据实验现象得出的结论错误的是( )
| 实验序号 | 实验现象 | 实验结论 |
| A | 氯水呈浅绿色 | 氯水中含有含有Cl2 |
| B | 向FeCl2溶液中滴加氯水,溶液变成棕黄色 | 氯水中含有HClO |
| C | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀 | 氯水中含有Cl﹣ |
| D | 向氯水中加入NaHCO3粉末,有气泡产生 | 氯水中含有H+ |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术。反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g)  1/4CaS(s)+CO2(g) ∆H1
1/4CaS(s)+CO2(g) ∆H1
②CaSO4(s)+CO(g)  CaO(s)+CO2(g) +SO2(g) ∆H2
CaO(s)+CO2(g) +SO2(g) ∆H2
③CO(g)  1/2C(s)+1/2CO2(g) ∆H3
1/2C(s)+1/2CO2(g) ∆H3
则反应2CaSO4(s)+7CO(g)  CaS(s)+CaO(s)+6CO2(g)+C(s) +SO2(g)的∆H=
CaS(s)+CaO(s)+6CO2(g)+C(s) +SO2(g)的∆H=
 (用∆H1、∆H2和∆H3表示)
(用∆H1、∆H2和∆H3表示)
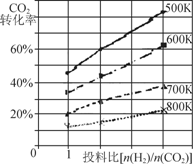
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g);ΔH
CH3OCH3(g)+3H2O(g);ΔH
①该反应平衡常数表达式为K= 。
②已知在某压强下,该反应在不同温度、不同投料
比时,CO2的转化率如右图所示。该反应的ΔH
____(填“>”“<”或“=”)0。若温度不变,减
小反应投料比[n(H2) /n(CO2)],则K将 (填“增大”“减小”或“不变”)。
③二甲醚燃料电池具有启动快,效率高等优点,若电解质为酸性,二甲醚燃料电池的负极反应为 。
(3)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2nCu+(n+1)O2+(2-2n) H2O=2nCuSO4+(2-2n) H2SO4
 从环境保护的角度看,催化脱硫的意义为
从环境保护的角度看,催化脱硫的意义为
。
②利用右图所示电化学装置吸收另一部分SO2,
并完成Cu的再生。写出装置内所发生反应的
总的离子方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com