
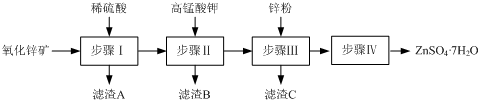
分析 氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)加稀硫酸溶解,过滤,滤液中含有硫酸锌、硫酸铜、硫酸亚铁,再加高锰酸钾溶液与亚铁离子反应生成MnO(OH)2和氢氧化铁沉淀,过滤,滤液中含有硫酸铜和硫酸锌,加锌粉置换铜离子,过滤,滤渣为Cu可能含有Zn,滤液为硫酸锌,蒸发浓缩、冷却结晶、过滤得到ZnSO4•7H2O晶体;
(1)①根据温度对反应速率的影响分析;
②氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)加稀硫酸溶解,过滤,滤液中含有硫酸锌、硫酸铜、硫酸亚铁;
③用氢氧化钠溶液清洗过滤装置,目的是使反应生成的H2SiO3滤渣反应生成Na2SiO3溶解除去;
解答 解:氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)加稀硫酸溶解,过滤,滤液中含有硫酸锌、硫酸铜、硫酸亚铁,再加高锰酸钾溶液与亚铁离子反应生成MnO(OH)2和氢氧化铁沉淀,过滤,滤液中含有硫酸铜和硫酸锌,加锌粉置换铜离子,过滤,滤渣为Cu可能含有Zn,滤液为硫酸锌,蒸发浓缩、冷却结晶、过滤得到ZnSO4•7H2O晶体;
(1)①酸浸时,不断通入高温水蒸气可使反应液的温度升高,使反应物充分混合,以加快反应速率,
故答案为:升高温度,使反应物充分混合,以加快反应速率;
②氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)加稀硫酸溶解,过滤,滤液中含有硫酸锌、硫酸铜、硫酸亚铁,滤液中主要含有的金属阳离子为:Zn2+、Cu2+、Fe2+;
故答案为:Zn2+、Cu2+、Fe2+;
③滤渣A为硅酸沉淀,用氢氧化钠溶液清洗过滤装置,目的是使反应生成的H2SiO3滤渣与氢氧化钠反应生成Na2SiO3溶解除去,其发生的反应为:H2SiO3+2NaOH=Na2SiO3+2H2O,
故答案为:H2SiO3+2NaOH=Na2SiO3+2H2O.
点评 本题以ZnSO4•7H2O的制备为知识背景,考查了基本实验操作、氧化还原反应、化学反应速率的影响因素、化学方程式的书写、计算等知识,题目难度中等,侧重于考查学生的分析能力和实验能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应为放热反应 | B. | CO2分子中的化学键为非极性键 | ||
| C. | HCHO分子中只含δ键不含π键 | D. | 设生成1.8gH2O消耗2.24L O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.
甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物从土壤中吸收含氮养料 | |
| B. | 豆科植物把含氮化合物转变为蛋白质 | |
| C. | 将空气中的氮气转化为含氮化合物 | |
| D. | NH3经催化氧化生成NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑥⑧ | B. | ②③④⑦ | C. | ④⑤⑥⑧ | D. | ①④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78gNa2O2晶体中所含阴、阳离子个数均为2NA | |
| B. | PCl3和H2O分子中所有原子的最外层都达到8电子稳定结构 | |
| C. | 1.8gD2O含有NA个中子 | |
| D. | 3.4g氨气中含有0.6NA个N-H键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH减小 | B. | $\frac{c(N{H}_{4}^{+})}{c(O{H}^{-})}$增大 | ||
| C. | 水的电离程度先减小后增大 | D. | Kb(NH3•H2O)不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com