
下列物质分类的正确组合是 ( )
| | 碱 | 酸 | 盐 | 酸性氧化物 |
| A | 纯碱 | HNO3 | 胆矾 | SO2 |
| B | 烧碱 | H2SO4 | NaCl | CO |
| C | 苛性钠 | CH3COOH | 石灰石 | NO2 |
| D | 熟石灰 | H2CO3 | 苏打 | SiO2 |
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源:2013-2014广西贵港市毕业班5月高考冲刺模拟理综化学试卷(解析版) 题型:选择题
铅蓄电池在现代生活中有广泛应用,其电极材料是Pb 和PbO2,电解液是H2SO4溶液。现用铅蓄电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是
A.蓄电池放电时,电路中每转移2 mol电子,最多有1 molPbO2被还原
B.电解池的阳极反应式为:4OH--4e-=2H2O+O2↑
C.电解后, c(Na2SO4)不变,且溶液中有晶体析出
D.蓄电池中每生成1mol H2O,电解池中就消耗1mol H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014广西桂林市、崇左市、防城港市、北海市高三化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A、pH=1的溶液:Fe2+、NO3-、SO42-、Na+
B、c(H+)/c(OH-)=1012的溶液:NH4+、Al3+、NO3-、Cl-
C、c(Fe3+)=0.1 mol·L-1的溶液:K+、ClO-、SO42-、SCN-
D、水电离的c(H+)=l×10-14mol·L-1的溶液:Ca2+、K+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
物质发生化学变化时:①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物质的总能量,反应前后肯定不发生变化的是( )
| A.①③⑤ | B.①②⑤ | C.①⑤⑥ | D.①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学已经渗透到人类生活的各个方面,下列说法不正确的是
| A.食盐可作氯碱工业的原料 |
| B.碘酒是指单质碘的乙醇溶液 |
| C.大量使用化肥和农药,以提高农作物产量,符合绿色化学的原则 |
| D.低碳生活注重节能减排,尽量使用太阳能灯代替化石燃料,减少温室气体的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某实验小组用0.55 mol/L NaOH溶液和0.50 mol/L盐酸反应来测定中和热,实验装置如下图所示。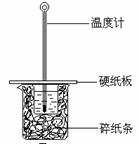
(1)图示实验装置中缺少的一种仪器是 ,大、小烧杯间填满碎纸条的作用是 。
(2)取50 mL NaOH溶液和50mL盐酸进行实验,实验数据如下表:
①请填写下表中的空白:
| 温度 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.1 | 3.0 |
| 2 | 25.9 | 25.9 | 25.9 | 28.8 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(12分)一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下: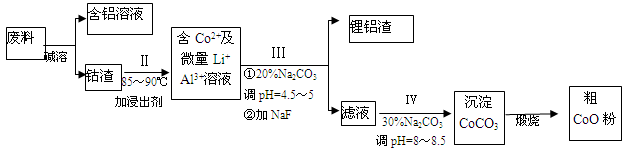
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液,加入Na2S2O3的作用是___________。在实验室模拟工业生产时,也可用盐酸代替酸化的Na2S2O3,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_________。
(3)用离子方程式表示过程Ⅳ中Na2CO3的主要作用_______。
(4)下图是CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,B物质的化学式是______。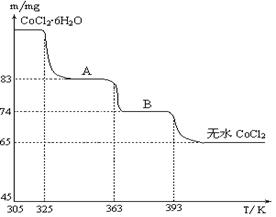
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有一澄清透明的溶液,只可能含有大量的Fe3+、Fe2+、H+、AlO2-、Al3+、CO32-、NO3-七种离子中的几种,向该溶液中逐滴加入一定量1 mol·L-1 NaOH溶液的过程中,开始没有沉淀,而后才有沉淀。则下列判断正确的是( )
| A.溶液中可能含有AlO2- | B.溶液中可能含有NO3- |
| C.溶液中一定不含Fe2+和Fe3+ | D.溶液中可能含有Fe3+,但一定不含Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com