
| 实验步骤 | 实验现象 | 结论 |
科目:高中化学 来源: 题型:选择题
| A. | 由Cl2+2KBr═2KCl+Br2所以F2也能与KBr溶液反应置换出Br2 | |
| B. | 常温下,由Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,所以Fe也能与浓硝酸反应产生NO2 | |
| C. | 由Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2 所以Cu+I2$\frac{\underline{\;\;△\;\;}}{\;}$CuI2 | |
| D. | 由钠保存在煤油中,所以钾也可以保存在煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
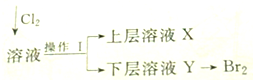 实验室用含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的溶液进行有关实验.已知:Cl2+2Br-=Br2+2Cl-.
实验室用含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的溶液进行有关实验.已知:Cl2+2Br-=Br2+2Cl-.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何物质都含有约6.02×1023个原子 | |
| B. | 0.012kg 12C约含有6.02×1023个碳原子 | |
| C. | 使用物质的量时,应指明粒子的种类 | |
| D. | 1mol H2的质量是2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g H2 | B. | 5.6L SO2 | C. | 24g Mg | D. | 22.4L CO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com