
 在两支试管中分别加入3mL稀盐酸(均足量),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中.
在两支试管中分别加入3mL稀盐酸(均足量),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中.| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
| ① | 50mL水 | 2.5gNaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2gNa2CO3固体 | 20℃ | 23.3℃ |
| ③ | 35mL稀盐酸 | 含2.5gNaHCO3的 饱和溶液15mL | 20℃ | 18.8℃ |
| ④ | 50mL稀盐酸 | 含3.2gNa2CO3的 饱和溶液15mL | 20℃ | 21.2℃ |
| ⑤ | 50mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 17.4℃ |
| ⑥ | 50mL稀盐酸 | 3.2gNa2CO3固体 | 20℃ | 24.4℃ |
分析 (1)①碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,据此书写;
②NaHCO3和Na2CO3与盐酸反应在同一条件下的速率不同,碳酸氢钠反应速率更快;
③根据碳酸钠、碳酸氢钠与二氧化碳的关系式计算大小气球体积之比;
④物质溶解吸热,会使温度降低;
(2)由图表知,该实验中缺少测量温度和测量固体质量的仪器;
根据NaHCO3、Na2CO3的分别溶于水的温度变化来判断它们溶于水时是吸热反应还是放热反应;根据NaHCO3、Na2CO3的分别与盐酸反应的温度变化来判断它们溶于水时是吸热反应还是放热反应.
解答 解:(1)①碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,离子方程式为:HCO3-+H+═CO2↑+H2O,碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,离子方程式为:CO32-+2H+═CO2↑+H2O,故答案为:HCO3-+H+═CO2↑+H2O;CO32-+2H+═CO2↑+H2O;
②装有NaHCO3溶液的试管中很快产生气泡,而装有Na2CO3溶液的试管中开始没有气泡产生,但随着滴入稀盐酸的量增加,才会产生气泡,
故答案是:两支试管中都产生气泡,但装有NaHCO3的试管中反应速率快得多;
③盐酸与碳酸钠反应的化学方程式为:Na2CO3+HCl=NaCl+NaHCO3,
盐酸与碳酸氢钠反应的化学方程为:NaHCO3+HCl=NaCl+H2O+CO2↑,
根据二者与盐酸反应的化学方程式可知,Na2CO3的相对分子质量比NaHCO3的大,故相同质量的Na2CO3与NaHCO3中,NaHCO3与盐酸反应生成的CO2气体多一些.
碳酸钠、碳酸氢钠与二氧化碳的关系式分别为:
Na2CO3----CO2; NaHCO3----CO2;
106g 22.4L 84g 22.4L
0.3g 0.063L 0.3g 0.08L
所以试管中气球大小(包含试管)体积之比约为:Ⅰ:Ⅱ=0.063:0.08:=42:53,
故答案为:42:53;
④由于碳酸钠、碳酸氢钠溶解过程中会吸收热量,且物质的状态影响放出能量大小,不能根据用手触摸试管的冷热判断碳酸钠、碳酸氢钠与盐酸反应的反应热情况,
故答案为:不正确;
(2)测量温度需要温度计、称量固体需要托盘天平,
故答案为:温度计;托盘天平;
a.根据表中数据可知,当NaHCO3溶于水后,混合溶液的温度降低,则NaHCO3的溶解是为吸热过程,故答案为:吸热;
b.Na2CO3的饱和溶液和盐酸反应后,反应后混合液温度比碳酸钠与水反应后的温度更高,说明碳酸钠与盐酸的反应为放热反应,
故答案为:放热;
c.NaHCO3的饱和溶液和盐酸反应后,反应后混合溶液的温度比碳酸氢钠与水反应后的温度更低,说明碳酸氢钠与盐酸反应为吸热反应,
故答案为:吸热.
点评 本题以实验探究考查碳酸钠、碳酸氢钠的性质及与酸反应的热效应,题目难度中等,把握表格中实验数据的分析为解答的关键,注意变量控制法的应用.


科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+、SO42-、Cl-不能大量共存,只是因为:Mg2++SO42-═MgSO4↓ | |
| B. | H+、Fe2+、NO3-ClO-不能大量共存,只是因为:H++ClO-═HClO | |
| C. | K+、Ca2+、SiO32-、Cl-不能大量共存,只是因为:Ca2++SiO32-═CaSiO3↓ | |
| D. | Fe3+、NH4+、HCO3-、SCN-不能大量共存,这是因为:Fe3++3SCN-═Fe(SCN)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
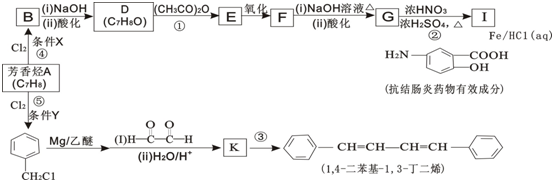
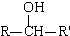 (R、R′表示烃基)
(R、R′表示烃基)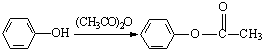
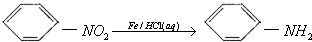
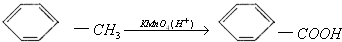

 .
.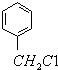 有氯原子的方法是将少量样品与NaOH溶液在试管中混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液,若有白色沉淀,则证明有氯元素.
有氯原子的方法是将少量样品与NaOH溶液在试管中混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液,若有白色沉淀,则证明有氯元素.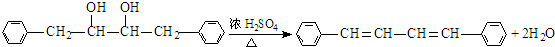 .
.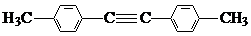
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 略大于20% | C. | 略小于20% | D. | 80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有4种无色液态物质:己烯、己烷、苯和甲苯.按要求填空:
有4种无色液态物质:己烯、己烷、苯和甲苯.按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
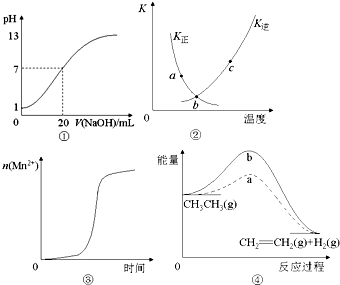
| A. | 图①表示25℃时,用0.1 mol•L-1NaOH溶液滴定20 mL 0.1 mol•L-1 盐酸溶液,溶液的pH随加入NaOH溶液体积的变化 | |
| B. | 图②中表示反应2SO2(g)+O2(g)?2SO3(g);△H<0的有关曲线,图中a.b.c三点中只有b点已经达到化学平衡状态. | |
| C. | 图③表示10 mL 0.01 mol•L-1KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4 溶液混合时,n(Mn2+) 随时间的变化(Mn2+对该反应有催化作用) | |
| D. | 图④中a、b曲线分别表示反应CH3CH3→CH2=CH2 (g)+H2(g);△H>0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com