
【题目】M(NO3)2热分解化学方程式为2M(NO3)2![]() 2MO+4NO2↑+ O2↑,加热29.6 g M(NO3)2使其完全分解,在标准状况下收集11.2 L的气体,那么M的摩尔质量是
2MO+4NO2↑+ O2↑,加热29.6 g M(NO3)2使其完全分解,在标准状况下收集11.2 L的气体,那么M的摩尔质量是
A.24 g·mol-1B.74 g·mol-1
C.148 g·mol-1D.40 g·mol-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如图,
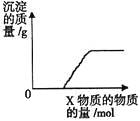
符合图中情况的一组物质是
A | B | C | D | |
X | Ba(HCO3)2 | Na2CO3 | KOH | CO2 |
Y | NaOH | CaCl2 | Mg(HSO4)2 | 石灰水 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH = — 92.0kJ·mol-1,恒容时,体系中各物质浓度随时间变化曲线如图所示,下列说法正确的是( )
2NH3(g) ΔH = — 92.0kJ·mol-1,恒容时,体系中各物质浓度随时间变化曲线如图所示,下列说法正确的是( )

A. 25min时采取的措施是降低温度或增大压强
B. 将0.5 mol氮气、1.5 mol氢气置于1 L密闭容器中发生反应,放出的热量为46 kJ
C. Ⅰ、Ⅱ、Ⅲ 三个时间段分别是改变一个条件引起的平衡移动,平衡时平衡常数:KⅢ > KⅠ = KⅡ
D. 为了增大合成氨的产率可以通过使用催化剂、原料的循环使用来实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100 mL 0.3 mol·L-1 Na2SO4溶液和50 mL 0.2 mol·L-1 Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为( )
A. 0.20 mol·L-1B. 0.25 mol·L-1
C. 0.40 mol·L-1D. 0.50 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。发生的反应如下:

CH3CH2CH2CH2OH![]() CH3CH2CH2CHO ,反应物和产物的相关数据列表如下:
CH3CH2CH2CHO ,反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,与5 mL浓硫酸形成混合溶液,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在E中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77 ℃馏分,产量2.0 g。
回答下列问题:
(1)实验中,Na2Cr2O7溶液和浓硫酸添加的顺序为___________________________。
(2)加入沸石的作用是________________________________________________。
若加热后发现未加沸石,应采取的正确方法是______________________________。
(3)上述装置图中,D仪器的名称是________,E仪器的名称是________。
(4)分液漏斗使用前必须进行的操作是________。
(5)将正丁醛粗产品置于分液漏斗中分水时,正丁醛在_______________层(填“上”或“下”)。
(6)反应温度应保持在90~95 ℃,其原因是__________________________________、__________________________________________________。
(7)本实验中,正丁醛的产率为________%(结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)O2和O3是氧元素的两种单质。根据分子式回答。等质量的O2和O3的物质的量之比为____,原子个数比为_____。
(2)NO2和N2O4是氮元素的两种常见氧化物,常温下都是气体,它们之间在常温下就能相互转化,因而经常见到的是两种气体的混合物。现取46g该气体,所含氮原子的物质的量为_____。
(3)已知三种物质NaCl、MgCl2、AlCl3分别溶于水,若溶液中的钠、镁、铝三种元素的质量比为23︰16︰9。则:
①NaCl、MgCl2、AlCl3三种物质的物质的量之比为_____;
②其中所含Cl-物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中发生反应:xA(g) +B(g)![]() 2C(g) △H<0,A、 C的物质的量随时间变化的关系如图。下列有关说法正确的是
2C(g) △H<0,A、 C的物质的量随时间变化的关系如图。下列有关说法正确的是

A. x=1
B. 反应进行到1min时,反应体系达到化学平衡状态
C. 2min后,A的正反应速率一定等于C的逆反应速率
D. 2min后,容器中A与B的物质的量之比一定为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定条件下,铁可以和![]() 发生反应:
发生反应:![]() ,已知该反应的平衡常数
,已知该反应的平衡常数![]() 与温度
与温度![]() 的关系如图所示。
的关系如图所示。
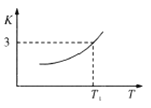
①该反应是_______________(填“吸热”或“放热”)的反应。
②在恒温恒容的容器中进行该反应,下列能说明反应达到平衡状态的是_____________(填字母代号)
A. ![]() 的浓度保持不变
的浓度保持不变
B.容器内总压强不再变化
C. ![]()
D.混合气体的平均相对分子质量不再变化
③![]() 温度下,向体积为
温度下,向体积为![]() 的密闭容器中加入足量铁粉并充入一定量的
的密闭容器中加入足量铁粉并充入一定量的![]() ,则
,则![]() 的平衡转化率为_______。
的平衡转化率为_______。
(2)甲醇燃料电池中,若电解质溶液中![]() 的物质的量为
的物质的量为![]() ,当有
,当有![]() 甲醇参与反应时,所得溶液中离子浓度由大到小的顺序是_________________________。
甲醇参与反应时,所得溶液中离子浓度由大到小的顺序是_________________________。
(3)用![]() 与
与![]() 干法制备
干法制备![]() 的反应历程中包含的热化学方程式有:
的反应历程中包含的热化学方程式有:
![]()
![]()
![]()
![]()
则反应![]() 的
的![]() ______
______![]() (用含
(用含![]() 的代数式表示)。
的代数式表示)。![]() 早在1841年利用纯铁作电极插入浓的
早在1841年利用纯铁作电极插入浓的![]() 溶液电解制得
溶液电解制得![]() ,阳极生成
,阳极生成![]() 的电极反应式为___________;
的电极反应式为___________;![]() 等对其进行改进,在阴、阳电极间设置阳离子交换膜,有效提高了产率,阳离子交换膜的作用是________。
等对其进行改进,在阴、阳电极间设置阳离子交换膜,有效提高了产率,阳离子交换膜的作用是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I:在Na2SO3溶液中滴加酚酞,溶液变红色,若在该溶液中滴入过量的BaCl2溶液,现象是_________,请结合离子方程式,运用平衡原理进行解释_____________________。
II:等体积等物质的量浓度的 NaClO溶液与Na2SO3溶液混合后,溶液显______性。此时溶液中浓度相等的微粒是___________________________________________。
III:已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15 H2CO3:Ki1=4.3×10-7 Ki2=5.6×10-11,含H2S尾气用足量的Na2CO3溶液来吸收。写出离子反应方程式。____________,常温时,等体积等浓度的Na2S和Na2CO3溶液的离子总数:N前___N后(填“>”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com