

 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$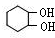 +2NaBr.C与足量银氨溶液反应的化学方程式OHC-CHO+4[Ag(NH3)2]OH
+2NaBr.C与足量银氨溶液反应的化学方程式OHC-CHO+4[Ag(NH3)2]OH H4NOOCCOONH4+4Ag↓+6NH3+2H2O
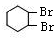
H4NOOCCOONH4+4Ag↓+6NH3+2H2O分析 环己烯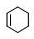 与溴发生加成反应生成A为
与溴发生加成反应生成A为 ,在氢氧化钠水溶液、加热条件下发生水解反应生成B为
,在氢氧化钠水溶液、加热条件下发生水解反应生成B为 ,A发生消去反应生成
,A发生消去反应生成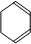 ,
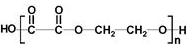
, 发生信息中反应生成OHCCH2CH2CHO、OHC-CHO,C与氢气发生加成反应生成F为醇、C发生氧化反应生成E为羧酸,故F、E含有相同碳原子数目,由F生成环醚G的分子式可知,C中含有2个C原子,则D为OHCCH2CH2CHO,C为OHC-CHO,则F为HOCH2CH2OH、E为HOOC-COOH,2分子HOCH2CH2OH发生脱水反应生成环醚G,F与E通过酯化反应进行的缩聚反应生成聚酯H,则H为
发生信息中反应生成OHCCH2CH2CHO、OHC-CHO,C与氢气发生加成反应生成F为醇、C发生氧化反应生成E为羧酸,故F、E含有相同碳原子数目,由F生成环醚G的分子式可知,C中含有2个C原子,则D为OHCCH2CH2CHO,C为OHC-CHO,则F为HOCH2CH2OH、E为HOOC-COOH,2分子HOCH2CH2OH发生脱水反应生成环醚G,F与E通过酯化反应进行的缩聚反应生成聚酯H,则H为 ,D与氢气发生加成反应生成I为HOCH2CH2CH2CH2OH,I在浓硫酸、加热条件下生成J,J分子中无饱和碳原子,应发生消去反应,可推知J为CH2=CHCH=CH2,J发生发生加聚反应得到合成橡胶
,D与氢气发生加成反应生成I为HOCH2CH2CH2CH2OH,I在浓硫酸、加热条件下生成J,J分子中无饱和碳原子,应发生消去反应,可推知J为CH2=CHCH=CH2,J发生发生加聚反应得到合成橡胶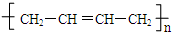 ,据此解答.
,据此解答.
解答 解:(1)根据以上分析,D为OHCCH2CH2CHO,名称是丁二醛,E为HOOC-COOH,含有的官能团的名称是羧基,H的结构简式 ,故答案为:丁二醛;羧基;
,故答案为:丁二醛;羧基; ;
;
(2)反应③是卤代烃在氢氧化钠醇溶液、加热条件下发生消去反应,C为OHC-CHO,则检验C中官能团醛基常用的试剂为 新制氢氧化铜悬浊液或银氨溶液,故答案为:氢氧化钠醇溶液、加热; 新制氢氧化铜悬浊液或银氨溶液;
(3)反应⑥是醛发生氧化反应生成羧酸,反应⑨是HOCH2CH2CH2CH2OH发生消去反应生成CH2=CHCH=CH2,故答案为:氧化反应;消去反应;
(4)反应②为 ,在氢氧化钠水溶液、加热条件下发生水解反应生成
,在氢氧化钠水溶液、加热条件下发生水解反应生成 ,反应的化学方程式为:
,反应的化学方程式为: +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +2NaBr,C为OHC-CHO,与足量银氨溶液反应的化学方程式OHC-CHO+4[Ag(NH3)2]OH
+2NaBr,C为OHC-CHO,与足量银氨溶液反应的化学方程式OHC-CHO+4[Ag(NH3)2]OH H4NOOCCOONH4+4Ag↓+6NH3+2H2O,故答案为:
H4NOOCCOONH4+4Ag↓+6NH3+2H2O,故答案为: +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +2NaBr;OHC-CHO+4[Ag(NH3)2]OH
+2NaBr;OHC-CHO+4[Ag(NH3)2]OH H4NOOCCOONH4+4Ag↓+6NH3+2H2O;
H4NOOCCOONH4+4Ag↓+6NH3+2H2O;
(5)D为OHCCH2CH2CHO,可以发生加聚反应,且能与碳酸氢钠反应,则含有碳碳双键和羧基,符合条件的同分异构体为 CH2=CH-CH2-COOH、CH3-CH=CH-COOH、CH2=C(CH3)-COOH共3种,其中核磁共振氢谱有3个不同的波峰,面积比1:2:3,其结构简式为CH2=C(CH3)-COOH,故答案为:3;CH2=C(CH3)-COOH.
点评 本题考查有机物的推断,需要学生对给予的信息进行利用,能较好的考查学生的自学能力,是常见题型,利用正推法与逆推法相结合进行推断,对学生的推理有一定的要求,熟练掌握官能团的性质,难度中等.


科目:高中化学 来源: 题型:实验题
 掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据实验装置图回答问题.
掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据实验装置图回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于石墨和金刚石属于不同的单质,所以△H1和△H2不等 | |
| B. | 由于燃烧反应放热,所以△H1和△H2均取正值 | |
| C. | 由于石墨和金刚石同为碳元素组成,所以△H1=△H2 | |
| D. | 由于燃烧均为放热反应,所以石墨为重要的能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(A-)>c(R+)>c(H+)>c(OH-) | B. | c(A-)>c(R+)>c(OH-)>c(H+) | ||
| C. | c(R+)>c(A-)>c(H+)>c(OH-) | D. | c(R+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 前4周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华,常用作制冷剂;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得一个电子后3p轨道全充满;D的最高化合价和最低化合价代数和为4,其最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,广泛用于电气工业.回答下列问题:
前4周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华,常用作制冷剂;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得一个电子后3p轨道全充满;D的最高化合价和最低化合价代数和为4,其最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,广泛用于电气工业.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com