
分析 (1)根据配制一定物质的量浓度的溶液方法骤排序;
(2)根据m=nM=cVM及天平的读数情况计算氯化钠的质量;
(3)如果加水超过了刻度线,需要重新配制;
(4)根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断.
解答 解:(1)配制一定物质的量浓度的溶液的步骤有:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,所以正确的操作顺序为:①②④③⑤,
故答案为:①②④③⑤;
(2)需要氯化钠的质量为:m=nM=cVM=0.5mol•L-1×0.5L×58.5g/mol=14.625g,天平的最小读数为0.1g,则需要称量的NaCl的质量为:14.6g,
故答案为:14.6g;
(3)定容时,如果加水超过了刻度线,溶液的体积偏大,导致配制溶液的浓度偏低,此次配制失败,需要重新配制,
故答案为:需重新配制溶液;
(4)①定容时,俯视刻度线,导致溶液的体积偏小,所以配制溶液的浓度偏高,
故答案为:偏高;
②移液后,未洗涤烧杯和玻璃棒,导致溶质的物质的量偏小.所以配制溶液的浓度偏低,
故答案为:偏低.
点评 本题考查了一定物质的量浓度溶液的配制,题目难度不大,注意掌握配制一定物质的量浓度的溶液方法,易错题是(4)题,误差的分析是学习的难点,会根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响来判断配制溶液的浓度是偏高还是偏低.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
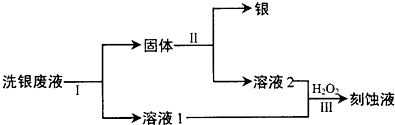
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
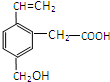 某有机物的结构如图所示,这种有机物不可能具有的性质是
某有机物的结构如图所示,这种有机物不可能具有的性质是| A. | ①④ | B. | 只有⑥ | C. | 只有③ | D. | ④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同 | B. | 中和HCl的多 | C. | 中和CH3COOH的多 | D. | 无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)18电子分子中含有4个原子,其结构式是H-O-O-H或PH3
(1)18电子分子中含有4个原子,其结构式是H-O-O-H或PH3查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2 | B. | CH≡C-CH3 | C. | CH2=CH2 | D. | CH2=CH-CH=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Na2O2固体中含有的阴离子数为2NA | |
| B. | 常温常压下,3.2g CH4中含有的电子数为2NA | |
| C. | 标准状况下,11.2L乙酸乙酯中含有的分子数为0.5NA | |
| D. | 100mL 1mol•L-1 CH3COOH溶液中含有的CH3COOH分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 0-6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L•min) | |
| B. | 6-10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L•min) | |
| C. | 反应到6min时,H2O2分解了50% | |
| D. | 反应到6min时,c(H2O2)=0.30mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.6g重水中含有的中子数为2NA | |
| B. | 16.0g的过氧(根)离子中含有的电子数为9NA | |
| C. | 100mL 3.0mol/L的盐酸与5.6g铁屑完全反应转移的电子数为0.3NA | |
| D. | 含2mol H2SO4的浓硫酸与足量金属铜完全反应,产生SO2分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com