
【题目】A、B、C、D四种短周期元素,原子序数依次增大,B、C同周期,A、D同主族且A为非金属性最强的元素,C的原子结构示意图为![]() ,A、B可形成BA2型化合物。据此填空:
,A、B可形成BA2型化合物。据此填空:
(1)C的元素名称为____,其气态氢化物的化学式为_____。
(2)A、B、C、D四种元素的原子半径由大到小的顺序为___(用元素符号表示)。
(3)B和D的最高价氧化物对应的水化物反应的离子方程式是_____。
(4)某同学根据元素周期律推知:A元素和D元素最高价氧化物对应的水化物酸性前者强。该同学的推断是否正确?____,请说明理由:_____。
【答案】硅 SiH4 Mg>Si>Cl>F Mg(OH)2+2H+= Mg2++2H2O 不正确 F无最高正价,不能形成该含氧酸
【解析】
A、B、C、D四种短周期元素,原子序数依次增大,根据C的原子结构示意图![]() ,可以知道C是硅,在元素周期表中位于第三周期,IVA,B的原子序数小于Si,且与硅同周期,能形成BA2型化合物,B只能为+2价,所以B为Mg,A为-1,A为F,再根据A、D同主族,则D为Cl,由上分析知:
,可以知道C是硅,在元素周期表中位于第三周期,IVA,B的原子序数小于Si,且与硅同周期,能形成BA2型化合物,B只能为+2价,所以B为Mg,A为-1,A为F,再根据A、D同主族,则D为Cl,由上分析知:
(1)C的元素名称为硅,其气态氢化物的化学式为SiH4;答案为硅,SiH4。
(2)镁、硅、氯处于同一周期,所以三者的半径关系与原子序数有关,序数大的半径小,所以Mg>Si>Cl,氟和氯属于同一主族,原子核外电子层多的半径大,所以Cl>F,综合起来Mg>Si>Cl>F;答案为Mg>Si>Cl>F。
(3)B是镁,D是氯,则镁元素最高价氧化物对应的水化物为氢氧化镁,氯元素的最高价氧化物的水化物为高氯酸,两者反应为Mg(OH)2+2HClO4=Mg(ClO4)2+2H2O,离子方程式为Mg(OH)2+2H+=Mg2++2H2O;答案为Mg(OH)2+2H+=Mg2++2H2O。
(4)A元素是氟元素,氟元素无正价,所以是没有含氧酸的存在,没有办法进行比较;答案为不正确,因为氟元素无正价,所以是没有含氧酸的存在。


科目:高中化学 来源: 题型:
【题目】乙烯的产量通常用来衡量一个国家的石油化工水平,某化学实验小组为了探究石蜡油(17个碳以上的液态烷烃混合物)分解产物中有乙烯存在,设计了如下实验方案:
(查阅资料可知:乙烯与酸性高锰酸钾溶液反应产生二氧化碳。)
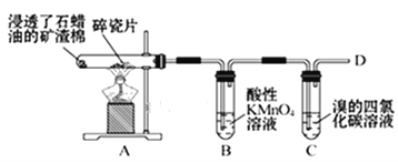
(1)乙烯的结构式是___。
(2)B中实验现象:___。
(3)C中发生反应的化学方程式:__,反应类型:___。
(4)通过上述实验探究可知,除去乙烷中混有的乙烯,可以选择的试剂是___。
A.水 B.溴水
C.氢氧化钠溶液 D.酸性高锰酸钾溶液
(5)关于乙烯,下列说法中不正确的是___。
A.聚乙烯塑料可以用做食品包装袋
B.乙烯在一定条件下可以和水反应制乙醇
C.乙烯分子中所有原子不共面
D.乙烯是一种植物生长调节剂,可以延长果实和花朵的成熟期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扁桃酸衍生物是重要的医药中间体,以A和B 为原料合成扁桃酸衍生物F路线如下:
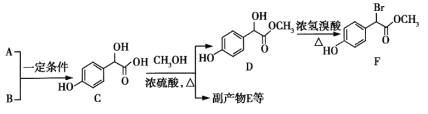
(1)A的分子式为C2H2O3,可发生银镜反应,且具有酸性,A所含官能团名称为:_________。写出A+B→C的化学反应方程式__________________________。
(2)C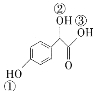 中①、②、③3个—OH的酸性由强到弱的顺序是:_______。
中①、②、③3个—OH的酸性由强到弱的顺序是:_______。
(3)E是由2分子C生成的含有3个六元环的化合物,E的分子中不同化学环境的氢原子有_____种。
(4)D→F的反应类型是______,1mol F在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为_______mol。写出符合下列条件的F的所有同分异构体(不考虑立体异构)的结构简式____。
①属于一元酸类化合物 ②苯环上只有2个取代基且处于对位,其中一个是羟基
(5)已知:![]() 。A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选)合成路线流程图示例如下:
。A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选)合成路线流程图示例如下:
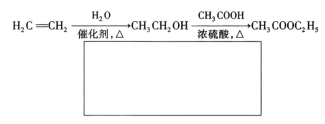
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D. Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是__________。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的 pH 均增大
②在相同时间内, 两烧杯中产生气泡的速度: 甲__________乙(填“>”、 “<”或“=”)。
③请写出图中构成原电池的负极电极反应式: ____________。
④当甲中溶液质量增重 31.5 克时,电极上转移电子数目为______。
(2)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是 KOH。通甲烷一极的电极反应方程式为 ______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,0.1000mol·L-lCH3COOH溶液中CH3COOH的电离度(×100%)约为1%。该温度下,用0.1000mol·L-l氨水滴定10.00mL0.1000mol·L-lCH3COOH溶液,溶液的pH与溶液的导电能力(I)的关系如图所示。下列说法中正确的是( )
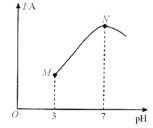
A.M点→N点,水的电离程度逐渐增大
B.25℃时,CH3COOH 的电离常数约为1.0×10-2
C.N点溶液中,c(CH3COO-)>c(NH4+)
D.当滴入20 mL氨水时,溶液中c(CH3COO-)>c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系正确的是
A. 沸点:新戊烷>2,2-二甲基戊烷>丙烷
B. 密度:CCl4>H2O>甲苯
C. 等质量的物质燃烧耗O2量:乙烷>乙烯>乙炔>甲烷
D. 等物质的量物质燃烧耗O2量:环己烷>苯>苯甲醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容密闭容器中,不能说明反应NH2COONH4(s)![]() 2NH3(g)+CO2(g)达到平衡状态的是
2NH3(g)+CO2(g)达到平衡状态的是
A. 混合气体的密度不再发生变化
B. 混合气体的总物质的量不再发生变化
C. 混合气体的平均相对分子质量不再发生变化
D. 混合气体的压强不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知还原性:Cl-<Fe2+<I-<SO2,判断下列反应不能发生的是( )
A.2Fe3++SO2+2H2O=![]() +4H++2Fe2+
+4H++2Fe2+
B.I2+SO2+2H2O=H2SO4+2HI
C.I2+2Cl-=Cl2+2I-
D.2Fe3++2I-=2Fe2++I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com