
| 物质 | 分子式 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) | 水溶性 |
| 甲 | C3H6O2 | -98 | 55.5 | 0.93 | 可溶 |
| 乙 | C4H8O2 | -84 | 87 | 0.90 | 可溶 |
科目:高中化学 来源:不详 题型:实验题
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用澄清石灰水鉴别Na2CO3和NaHCO3溶液 |
| B.用焰色反应鉴别NaCl和KCl |
| C.用丁达尔效应鉴别硫酸钠溶液和硅酸胶体 |
| D.用BaCl2溶液鉴别FeCl3溶液和Fe2(SO4)3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.盐酸、硫酸 | B.盐酸、氢氧化钠溶液 |
| C.氨水、硫酸 | D.氨水、氢氧化钠溶液 |
查看答案和解析>>
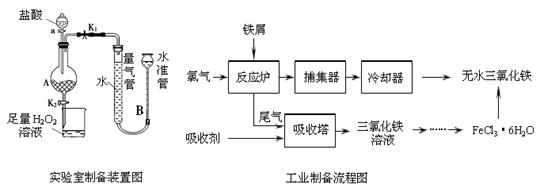
科目:高中化学 来源:不详 题型:填空题
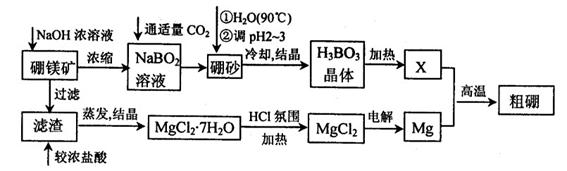
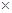 10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
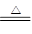 BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。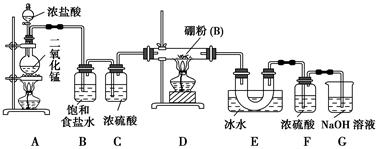
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 沉淀物 | 开始沉淀时的pH | 沉淀完全时的pH |
| Mg(OH)2 | 9.6 | 11.1 |
| Fe(OH)3 | 2.7 | 3.7 |
| 实验操作 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| 步骤3: | |
| …… | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com