
A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体甲;D的L层电子数等于K、M两个电子层上的电子数之和.
(1)写出A的原子结构示意图 .
(2)D的质子数和中子数相等,D的原子组成符号为 .
(3)用电子式表示A、D两元素形成AD2的过程: ;写出C2B2的电子式 .
(4)氢元素与B、D 均可以形成原子个数比为2:1的化合物,H2B的熔沸点高于H2D的原因是 .
(5)写出甲和A的最高价氧化物反应的化学方式: .
考点: 位置结构性质的相互关系应用.
分析: A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体甲,固体甲为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8﹣2=6,则D为S元素,据此解答.
解答: 解:A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体甲,固体甲为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8﹣2=6,则D为S元素.
(1)由上述分析可知,A为C元素,原子结构示意图为: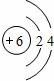 ,故答案为:
,故答案为: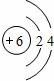 ;
;
(2)D为S元素,原子的质子数和中子数相等,质量数为32,D的原子组成符号为3216S,故答案为:3216S;
(3)A、D两元素形成CO2,用电子式表示其形成过程为: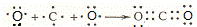 ,
,
C2B2为Na2O2,电子式是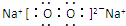 ,
,
故答案为: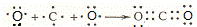 ;
;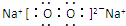 ;
;
(4)氢元素与O、S均可以形成原子个数比为2:1的化合物分别为H2O、H2S,由于H2O分子之间存在氢键,故H2O的沸点高于H2S,
故答案为:H2O分子之间存在氢键;
(5)二氧化碳与过氧化钠反应生成碳酸钠与氧气,化学反应方程式为:2Na2O2+CO2=2Na2CO3+O2,
故答案为:2Na2O2+CO2=2Na2CO3+O2.
点评: 本题考查结构性质位置关系应用,侧重对化学用语的考查,比较基础,注意对基础知识的积累掌握.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
下列结果是马虎同学回答同桌提问的答案,你认为需要改正的是()
①微粒半径:S2﹣>Cl﹣>S>Cl ②氢化物稳定性:HF>HCl>H2S>PH3③还原性:Na>Mg>Al>K ④氧化性:Cl2>S>O2>F2 ⑤酸性:H2SO4>HClO4>H2SiO3>H3PO4 ⑥得电子能力:F>Cl>Br>I.
A. 只有③ B. ③④⑤ C. ②④⑤⑥ D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,W溶液中加入KSCN出现血红色.
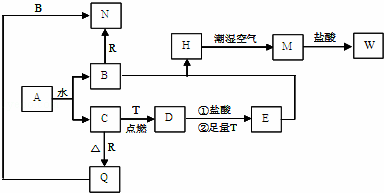
(1)写出下列物质的化学式:D: E: N: .
(2)B与E混和得到H并在潮湿空气中变成M的过程中,可能观察到的现象: ;
(3)按要求写方程式:
B和R反应生成N的离子方程式: ;
M→W的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
120℃,某气态烃在密闭容器中与足量的O2混合点燃,完全燃烧后恢复至原温度,容器内的压强保持不变,则该烃是()
A. CH4 B. C2H6 C. C3H6 D. C3H8
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应A2+B2═2AB的能量变化如图所示,则下列说法正确的是()
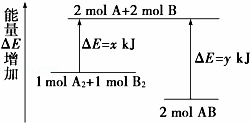
A. 该反应是吸热反应
B. 断裂1 mol A﹣A键和1 mol B﹣B键能放出x kJ能量
C. 形成2 mol A﹣B键需要放出y kJ的能量
D. 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是()
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体.
A. ①和② B. ①和③ C. ③和④ D. ①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是(NA表示阿伏加德罗常数)()
A. 常温常压下,22.0 gCO2所含的电子数为22NA
B. 常温常压下,1mol氦气含有原子数为NA
C. 0.5mol•L﹣1 Na2CO3溶液中含有Na+离子的数目为NA
D. 标准状况下,22.4LCCl4含有的氯原子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数
据回答下列问题:
(1)该盐酸中HCl的物质的量浓度为 mol•L﹣1
(2)某同学用上述浓盐酸和蒸馏水配制浓度为0.4mol•L﹣1体积为425mL的稀盐酸.
①该学生需要取 mL上述浓盐酸进行配制.
②配制过程中,所用到的仪器除烧杯、玻璃棒、量筒外还需 、 .
③上述实验中,需要用到玻璃棒,其作用是 、 .
④在配制过程中,下列操作对配制的稀盐酸的物质的量浓度有何影响(填“偏 大”、“偏小”或“无影响”)
Ⅰ.用量筒量取浓盐酸时俯视观察凹液面
Ⅱ.定容时仰视刻度线 .

查看答案和解析>>
科目:高中化学 来源: 题型:
科学家研制出以锶原子为钟摆的“晶格钟”成为世界上最精准的钟.锶元素在元素周期表中的信息与锶原子结构示意图如图所示,下列说法错误的是( )
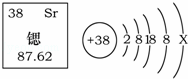
|
| A. | Sr为金属元素 | B. | 乙图中X=2 |
|
| C. | 锶原子的质量为87.62g | D. | 锶原子的质子数是38 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com