
硫元素有多种化合价,可形成多种化合物。
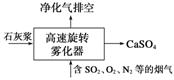
(1)旋转喷雾干燥法是去除燃煤烟气中二氧化硫的方法之一,工艺流程如下图所示,写出雾化器中发生反应的化学方程式:________________________________________________。
(2)已知NaHSO3溶液显弱酸性,其原因用离子方程式表示为____________。
(3)请按照浓度由大到小的顺序排列0.1 mol·L-1 Na2SO3 溶液中的离子________。Na2SO3溶液放置于空气中一段时间后,溶液的pH________(填“增大”、“减小”或“不变”)。
(4)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。
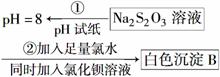
实验①可说明________(填字母)。
A.该Na2S2O3溶液中水电离的c(OH-)=10-8 mol·L-1
B.H2S2O3是一种弱酸
C.Na2S2O3是一种弱电解质
D.Na2S2O3能发生水解,其离子方程式为S2O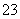 +2H2O===H2S2O3+2OH-
+2H2O===H2S2O3+2OH-
实验②说明Na2S2O3具有________性。写出发生反应的离子方程式______________。
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
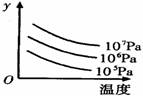
有某可逆反应aA(g)+bB(g) cC(g);右图表示外界条件(温度、压强)的变化对上述反应的影响。下列判断正确的是( )
cC(g);右图表示外界条件(温度、压强)的变化对上述反应的影响。下列判断正确的是( )
A.a+b<c时,y轴表示平衡混合气中C的质量分数
B.a+b<c时,y轴表示平衡混合气的平均摩尔质量
C.△H>0时,y轴表示达到平衡时B的转化率
D.△H<0时,y轴表示达到平衡时A的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的Na2O2和NaHCO3混合后,在密闭容器中加热充分反应,排出气
体,冷却后有固体物质剩余,下列选项不正确的是( )。
| Na2O2/mol | NaHCO3/mol | 剩余的固体物质 | |
| A | 1 | 2 | Na2CO3 |
| B | 1.5 | 2 | Na2O2 Na2CO3 |
| C | 2 | 1 | Na2O2 NaOH Na2CO3 |
| D | 2 | 2 | NaOH Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.石墨烯[如图(甲)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(乙)所示]。
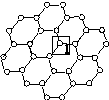
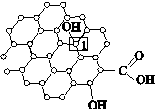
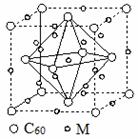
(甲)石墨烯结构 (乙)氧化石墨烯结构 (丙)
(1)图(甲)中,1号C与相邻C形成σ键的个数为________。
(2)图(乙)中,1号C的杂化方式是________,该C与相邻C形成的键角________(填“>”“<”或“=”)图(甲)中1号C与相邻C形成的键角。
(3)若将图(乙)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图(丙)所示,M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为________,该材料的化学式为________。
Ⅱ.ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(5) H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
 ①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因: 。
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因: 。
②H2SeO4比H2SeO3酸性强的原因: 。
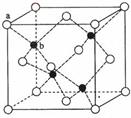
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如右图所示,其晶胞边长为540.0pm,其密度为
g/cm3(列式并计算),a位置S2-与b位置Zn2+之间的距离为 pm(列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,下列说法正确的是( )
A.常温下,pH相等的NaOH溶液和CH3COONa溶液中由水电离产生的c(OH-)相等
B.由水电离的c(H+)=1×10-11 mol·L-1的溶液一定是碱性溶液
C.两种难溶性盐,Ksp较小的,其溶解度也一定较小
D.Na2CO3溶液和NaHCO3溶液中一定都存在:
2c(CO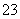 )+c(OH-)+c(HCO
)+c(OH-)+c(HCO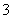 )=c(H+)+c(Na+)
)=c(H+)+c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数,下列说法正确的是( )
A.23 g Na在氧气中完全燃烧失电子数为0.5NA
B.1 L 2 mol·L-1的MgCl2溶液中含Mg2+数为2NA
C.标准状况下,11.2 L SO3所含分子数为0.5NA
D.室温下,8 g甲烷含有共价键数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:
(1)一定条件下,2.3 g的Na与O2完全反应生成3.6 g产物时失去的电子数为________。
(2)向氯化铜溶液中加入一定量的铁粉和铝粉混合物,充分反应后,下列情况可能出现的是________(填字母)。
a.溶液中有Cu2+、Fe2+、Al3+,不溶物为Cu
b.溶液中有Fe2+、Al3+,不溶物为Cu、Fe
c.溶液中有Fe3+、Al3+,不溶物为Cu
d.溶液中有Fe2+,不溶物为Cu、Al
(3)将一定质量的铁、铝、铜合金,加入1 L一定物质的量浓度的硝酸中,合金完全溶解,测得溶液中(忽略溶液体积的变化)c(H+)=0.5 mol·L-1,c(Cu2+)=0.3 mol·L-1,c(Al3+)=0.2 mol·L-1,c(NO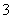 )=2 mol·L-1,则混合物中铁的质量最少为________。
)=2 mol·L-1,则混合物中铁的质量最少为________。
(4)铁的某种氧化物的化学式表示为FexO(x<1),已知铁元素在该氧化物中的质量分数为75%,则x=______(精确至0.01)。
(5)Na—Al/FeS是一种可充电电池,电池中用含Na+导电固体作为电解质,在工作过程中Na+的物质的量保持不变。
①若该正极的电极反应式表示为2Na++FeS+2e-===Na2S+Fe,则电池的负极反应式可表示为________________;充电时,阳极发生反应的物质是________。
②用该电池作电源,组成如图所示装置,若通电5 min时,铜电极质量增加1.08 g,则该电源电极X名称为________。图中装置A、B的pH变化为A__________、B________(填“增大”、“减小”或“不变”)。
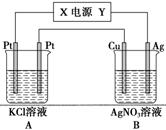
查看答案和解析>>
科目:高中化学 来源: 题型:
x、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知
A.x的原子半径大于y的原子半径 B.x的电负性大于y的电负性
C.x的能层数性等于y的能层数 D.x的第一电离能小于y的第一电离能
查看答案和解析>>
科目:高中化学 来源: 题型:
有①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液各25 mL,物质的量浓度均为0.1 mol/L,下列说法正确的是( )
A.3种溶液pH的大小顺序是③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25 mL 0.1 mol·L-1的盐酸后,pH最大的是①
D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com