
 CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是| A.升温,平衡向正反应方向移动,溶液的pH值不变 |
| B.加水,反应速率加快,平衡向逆反应方向移动 |
| C.滴加少量0.lmol·L-1 HCl溶液,溶液中c(H+)减少 |
| D.加入少量CH3COONa固体,平衡向逆反应方向移动 |
 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.相同浓度的两溶液中c(H+)相同 |
| B.100mL0.1mol/L的两溶液能中和等物质的量的氢氧化钠 |
| C.pH=3的两溶液都稀释10倍,盐酸的pH大于醋酸的PH |
| D.两溶液中分别加人少量对应的钠盐,c(H+)均明显减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | ① | ② | ③ | ④ |
| pH | 12 | 12 | 2 | 2 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.醋酸溶液能和碳酸钠反应生成CO2和水 |
| B.25℃时,测得0.1mol.L-1醋酸钠溶液的pH约为8 |
| C.25℃时,测得0.1mol.L-1醋酸溶液的pH约为3 |
| D.同温,同浓度、同体积的稀盐酸和稀醋酸分别与足量的锌粒反应,两者生成氢气一样多,但盐酸的反应比醋酸快 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
| B.因为CH3COOH是弱电解质,HCl是强电解质,所以中和等体积等物质的量浓度的醋酸和盐酸时,中和醋酸消耗的NaOH比盐酸消耗的NaOH用量少 |
| C.物质的量浓度相同的磷酸钠溶液和磷酸溶液中PO43-的物质的量浓度相同 |
| D.足量Zn分别和等体积、等物质的量浓度的盐酸和醋酸反应时,产生H2的量相同,放出H2的速率不等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 mol/L 硫酸溶液中H+浓度为2 mol/L |
| B.能跟锌反应产生氢气 |
| C.能使石蕊试液变红 |
| D.能与碳酸钠反应放出二氧化碳气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
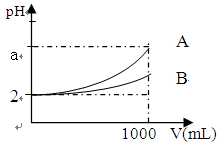
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
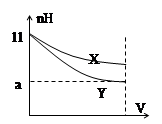
| A.X、Y两种碱的物质的量浓度一定相等 |
| B.稀释后,X溶液碱性比Y溶液碱性强 |
| C.若9<a<11,则X、Y都是弱碱 |
| D.完全中和X、Y两溶液时,消耗同浓度盐酸的体积V(X)>V(Y) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com