

| A. | A与金属钠完全反应时,两者反应的物质的量之比为1:3 | |
| B. | lmolA最多能与5mol氢气发生反应,反应类型是加成反应 | |
| C. | 1molA与足量碳酸氢钠溶液反应,生成CO2的物质的量为2mol | |
| D. | A既能与羧基反应,又能与醇反应,还能发生水解反应 |
分析 由结构可知,分子中含HCOO-、-COOH、-OH,结合甲酸某酯、羧酸、醇的性质来解答.
解答 解:A.-COOH、-OH与Na反应,则A与金属钠完全反应时,两者反应的物质的量之比为1:2,故A错误;
B.只有苯环与氢气发生加成反应,则lmolA最多能与3mol氢气发生反应,故B错误;
C.只有-COOH与碳酸氢钠反应,则1molA与足量碳酸氢钠溶液反应,生成CO2的物质的量为1mol,故C错误;
D.含-OH与羧酸反应,含-COOH与醇反应,且含-COOC-可发生水解反应,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
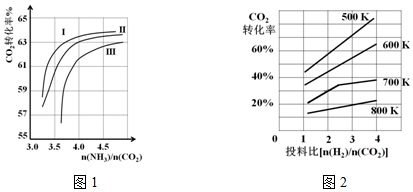
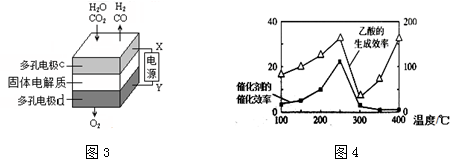
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4使酸性高锰酸钾溶液褪色 | B. | C2H4使溴的CCl4溶液褪色 | ||
| C. | 苯的燃烧 | D. | CH4与氯气在光照条件下的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X射线透视肠胃的内服剂--碳酸钡 | |
| B. | 配制波尔多液原料--胆矾和石灰乳 | |
| C. | 生活用水的消毒剂--明矾 | |
| D. | 工业生产氯气的原料--浓盐酸和二氧化锰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 两个容积均为10L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g)?N2(g)+2CO2(g),起始物质的量见下表.实验测得两容器不同温度下达到平衡时CO2的物质的量浓度如图所示,下列说法错误的是( )
两个容积均为10L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g)?N2(g)+2CO2(g),起始物质的量见下表.实验测得两容器不同温度下达到平衡时CO2的物质的量浓度如图所示,下列说法错误的是( )| 容器 | 起始物质的量 | ||
| NO | CO | ||
| Ⅰ | 1mol | 0.5mol | |
| Ⅱ | 2mol | 1mol | |
| A. | 反应N2(g)+2CO2(g)?2NO(g)+2CO(g)的△H<0,△S>0 | |
| B. | P点的速率比M点慢 | |
| C. | M、N两点容器内的压强:P(M)<2P(N) | |
| D. | N点的平衡常数为44.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 总反应的速率由反应①的速率决定 | |
| B. | 反应④的焓变小于0 | |
| C. | HClI是上述总反应的催化剂 | |
| D. | 正反应活化能E${\;}_{{a}_{1}}$与逆反应活化能E${\;}_{{a}_{2}}$之差为a kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com