
| A. | NH3和NH4Cl | B. | HCl和SiO2 | C. | KCl和K | D. | CO2和H2O |
分析 根据晶体的类型和所含化学键的类型分析,离子化合物一定含有离子键,可能含有共价键,共价化合物只含共价键,双原子分子或多原子分子含有共价键,以此解答.
解答 解:A.NH3是分子晶体,NH3中只含共价键;NH4Cl是离子晶体,NH4Cl中含有离子键和共价键,故A错误;
B.HCl是分子晶体,SiO2为原子晶体,故B错误;
C.KCl为离子晶体,含有离子键,K为金属晶体,含有金属键,故C错误;
D.H2O和CO2都是分子晶体,CO2和H2O都只含共价键,故D正确;
故选D.
点评 本题考查化学键类型和晶体类型的关系,为高频考点,侧重双基的考查,有利于培养学生良好的科学素养,提高学习的积极性,注意判断依据为:离子晶体中阴阳离子以离子键结合,原子晶体中原子以共价键结合,分子晶体中分子之间以范德华力结合,分子内部存在化学键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na2SO4 H2SO4 AlCl3 BaCl2 | B. | HCl NaOH K2SO4 NaHCO3 | ||
| C. | AlCl3 KHCO3 NaCl Na2SO4 | D. | NaOH FeCl3 MgCl2 K2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
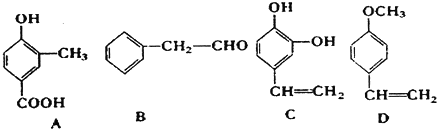
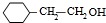 ;1molC最多能与3mol Br2发生反应.
;1molC最多能与3mol Br2发生反应. H
H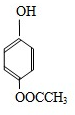 .G和NaOH溶液反应的化学方程式为
.G和NaOH溶液反应的化学方程式为 +2NaOH→
+2NaOH→ +HCOONa+H2O.
+HCOONa+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KIO3 | B. | 苯甲酸钠 | C. | 维生素E | D. | NaNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
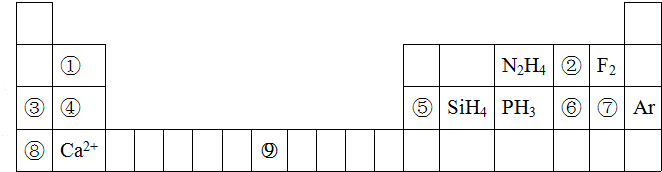
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极附近SO42-浓度逐渐增大 | |
| B. | 电子通过导线由铜片流向锌片 | |
| C. | 正极反应式为Zn-2e-═Zn2+ | |
| D. | 该原电池工作过程中电解质溶液的pH值增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com