
下列实验过程中出现异常情况,其可能原因分析错误的是
| 选项 | 异常情况 | 可能原因分析 |
| A | 蒸发结晶:蒸发皿破裂 | 将溶液蒸干或酒精灯灯芯碰到热的蒸发皿底部 |
| B | 分液:分液漏斗中的液体难以滴下 | 没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐 |
| C | 萃取:液体静置不分层 | 加入萃取剂的量较多 |
| D | 检验F | Fe2+已部分被氧化成Fe3+ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
用坩埚钳夹住一小块刚用酸处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验现象的解释不正确的是 ( )
A.氧化铝未熔化 B.铝在空气中能很快形成氧化膜
C.氧化铝的熔点比铝高 D.酒精灯温度低,铝未熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室从海带灰中提取碘的操作过程中,仪器选用不正确的是
A.称取3 g左右的干海带——托盘天平
B.灼烧干海带至完全变成灰烬——蒸发皿
C.过滤煮沸后的海带灰和水的混合物——漏斗
D.用四氯化碳从氧化后的海带灰浸取液中提取碘——分液漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
学实验中的很多气体是用盐酸来制取的,这就导致了制取的气体中往往含有HCl杂质,要除去HCl杂质而得到纯净的目标气体,可用图示装置。如果广口瓶盛装的是饱和NaHCO3溶液,则可以用于下列哪种气体的除杂装置
A.H2 B.Cl2
C.SO2 D.CO2

查看答案和解析>>
科目:高中化学 来源: 题型:
标准氢氧化钠溶液中和醋酸时,当溶液的pH等于7,则此时( )
A.醋酸和氢氧化钠的物质的量相等
B.醋酸和氢氧化钠完全中和
C.氢氧化钠过量
D.醋酸有剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸亚铁铵的化学式为(NH4)2SO4·FeSO4·6H2O,又名莫尔盐,是分析化学中常见的还原剂。某化学研究小组设计如下实验来制备莫尔盐并测定硫酸亚铁铵的纯度。
步骤一:铁屑的处理与称量。在盛有适量铁屑的锥形瓶中加入Na2CO3溶液,加热、过滤、洗涤、干燥、称量,质量记为m1。
步骤二:FeSO4的制备。将上述铁屑加入到一定量的稀硫酸中,充分反应后过滤并用少量热水洗涤锥形瓶和滤纸。滤液及洗涤液完全转移至蒸发皿中。滤渣干燥后称重,质量记为m2。
步骤三:硫酸亚铁铵的制备。准确称取所需质量的(NH4)2SO4加入“步骤二”中的蒸发皿中,缓缓加热一段时间后停止,冷却,待硫酸亚铁铵结晶后过滤。晶体用无水乙醇洗涤并自然干燥,称量所得晶体质量。
步骤四:用比色法测定硫酸亚铁铵的纯度。
回答下列问题:
(1)步骤三中称取的(NH4)2SO4质量为__________________________________________。
(2)①铁屑用Na2CO3溶液处理的目的是_________________________________________________。

制备FeSO4溶液时,用右图装置趁热过滤,原因是_________________________________________________。
②将(NH4)2SO4与FeSO4混合后加热、浓缩,停止加热的时机是_____________________________________。
③比色法测定硫酸亚铁铵纯度的实验步骤为:Fe3+标准色阶的配制、待测硫酸亚铁铵溶液的配制、比色测定。标准色阶和待测液配制时除均需加入少量稀盐酸外,还应注意的问题是____________________________________________。
④该实验最终通过______________________________
确定硫酸亚铁铵产品等级。
查看答案和解析>>
科目:高中化学 来源: 题型:
Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4+4CO 3Fe+4CO2,若有1 mol Fe3O4参加反应,转移电子的物质的量是________ mol。
3Fe+4CO2,若有1 mol Fe3O4参加反应,转移电子的物质的量是________ mol。
(2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降 除去,其原因是
除去,其原因是
________________________________________________________________________。
(3)某课外活动小组将下图所示装置按一定顺序连接,在实验室里制取一定量的FeCl3(所通气体过量并充分反应)。
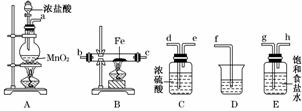
请回答下列问题:
①各装置的正确连接顺序为(填写装置代号)A→________→________→________→D。
②装置C的作用是______________________________________________。
③反应开始后,B中硬质玻璃管内的现象为_________________________________;
可以检验生成物中含有Fe3+的试剂是________(填写试剂名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的性质和该性质的应用均正确的是
A.常温下浓硫酸能是铝发生钝化,可在常温下用铝制贮藏贮运浓硫酸
B.二氧化硅不与任何酸反应,可用石英制造耐酸容器
C.二氧化氯具有还原性,可用于自来水的杀菌消毒
D.铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com