
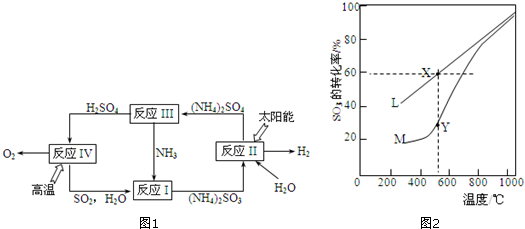
分析 (1)反应1是二氧化硫和氨气在水中反应生成亚硫酸铵的反应;
(2)据图分析,反应Ⅱ是太阳能转化为电能,电解亚硫酸铵生成硫酸铵和氢气;
(3)利用已知热化学方程式,据盖斯定律书写H2SO4(l)分解为SO2(g)、O2(g)及H2O(l)的热化学方程式;根据平衡移动考虑提高H2SO4(l)的分解率的方法;
(4)①Y点时反应还没有达到平衡状态,正向进行;温度的升高,曲线b向曲线a逼近,反应速率加快;
②利用三段式计算平衡时各组分物质的量,利用压强之比等于物质的量之比计算平衡时总压强,再计算各组分分压,根据Kp=$\frac{{p}^{2}(S{O}_{2})•p({O}_{2})}{{p}^{2}(S{O}_{3})}$计算.
解答 解:(1)反应1是二氧化硫和氨气在水中反应生成亚硫酸铵的反应,反应的离子方程式为SO2+H2O+2NH3=2NH4++SO32-,属于离子反应和化合反应,
故答案为:ab;
(2)反应Ⅱ是太阳能转化为电能,电解亚硫酸铵生成硫酸铵和氢气,阳极上是亚硫酸根离子得到电子生成硫酸根离子,电极反应为:SO32--2e-+H2O=SO42-+2H+,
故答案为;SO32--2e-+H2O=SO42-+2H+;
(3)已知H2SO4(l)=SO3(g)+H2O(g)△H=+177kJ•mol-1…(a)
2SO3(g)?2SO2(g)+O2(g)△H=+196kJ•mol-1…(b)
H2O(l)═H2O(g)△H=+44kJ•mol-1 (c)
据盖斯定律,2a+b-2c得:2H2SO4(l)?2SO2(g)+O2(g)+2H2O(l)△H=+462kJ•mol-1;
升高温度和及时分离SO2或O2都是提高H2SO4(l)的分解率方法,
故答案为:2H2SO4(l)?2SO2(g)+O2(g)+2H2O(l)△H=+462kJ•mol-1;升高温度和及时分离SO2或O2;
(4)①Y点时反应还没有达到平衡状态,正向进行,所以正反应速率大于逆反应速率,温度的升高,曲线b向曲线a逼近,反应速率加快,达到平衡时的时间缩短,
故答案为:>;温度升高,反应速率加快,达到平衡所需的时间缩短(或温度升高,反应速率加快,相同时间内更快达到平衡);
(5)起始时充入dmol SO3反应体系起始总压强0.1MPa.反应在一定的温度下达到平衡时SO3的转化率为60%,转化的二氧化硫为dmol×0.6=0.6dmol,则:
2 SO3(g)?2SO2 (g)+O2 (g)
起始量(mol):d 0 0
变化量(mol):0.6d 0.6d 0.3d
平衡量(mol):0.4d 0.6d 0.3d
恒温恒容下,平衡时总压强为0.1MPa×$\frac{(0.4d+0.6d+0.3d)mol}{dmol}$=0.13MPa,
故Kp=$\frac{{p}^{2}(S{O}_{2})•p({O}_{2})}{{p}^{2}(S{O}_{3})}$=$\frac{(0..1MPa×\frac{0.6}{1.3})^{2}×0.1MPa×\frac{0.3}{1.3}}{(0.1MPa×\frac{0.4}{1.3})^{2}}$=0.052MPa,
故答案为:0.052MPa.
点评 本题考查化学平衡计算、化学平衡图象、化学反应中能量变化、原电池电极反应式、元素化合物性质等,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,难度中等.


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②⑤⑥ | C. | ①④⑤ | D. | ②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 | |
| B. | 将水加热,Kw增大,pH不变 | |
| C. | 向水中加入少量固体HCl气体,平衡逆向移动,c(H+)降低 | |
| D. | 向水中加入少量固体硫酸钠,c(H+)和Kw均不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
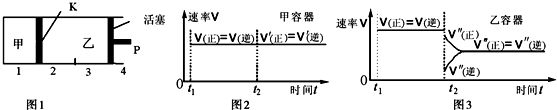
| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| C. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) | |
| D. | 保持活塞位置不变,升高温度,达到新的平衡后,甲中B的体积分数增大,乙中B的体积分数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 温度(℃) | 起始物质的量 (mol) | 平衡物质的量 (mol) | 达到平衡所需时(s) | |
| PCl5(g) | PCl3(g) | Cl2(g) | |||
| Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
| Ⅱ | 320 | 0.80 | t2 | ||
| Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
| A. | 平衡常数K:容器Ⅱ>容器Ⅲ | |
| B. | 反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ | |
| C. | 反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=$\frac{0.01}{{t}_{1}}$mol/(L•s) | |
| D. | 起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则反应将向逆反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下含有NA个氦原子的氦气的体积约为11.2L | |
| B. | 1 L 0.1 mol/LNaHSO4溶液中含有0.1NA个HSO4- | |
| C. | 标准状况下,22.4 L CCl4所含的分子数约为NA | |
| D. | CO和N2组成的42g混合气体中原子的个数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com