
大气中可吸入颗粒物PM2.5主要来源为燃煤、机动车尾气等。
(1)若取某PM2.5样本,用蒸馏水处理,测得溶液中含有的离子有:K+、Na+、NH4+、SO42-、NO3-、Cl-,则该溶液为 (填“酸性”或“碱性”)溶液,其原因用离子方程式解释是: 。
(2)“洗涤”燃煤烟气可减轻PM2.5中SO2的危害,下列可适用于吸收SO2的试剂有
A.CaCl2溶液 B.氨水 C.Ca(OH)2悬浊液 D.浓H2SO4
(3)煤烟气中的氮氧化物可用CH4催化还原成无害物质。若常温下,1molNO2与CH4反应,放出477.5kJ热量,该反应的热化学方程式是 。
(4)安装汽车尾气催化转化器也可减轻PM2.5的危害,其反应是:
2NO(g) + 2CO(g)  2CO2(g)+ N2(g);△H<0。
2CO2(g)+ N2(g);△H<0。
①该反应平衡常数表达式K= ;温度升高K值 (填“增大”或“减小” )
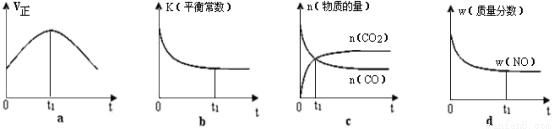
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 。
(5)使用锂离子电池为动力汽车,可减少有害气体的排放。锰酸锂离子蓄电池的反应式为:
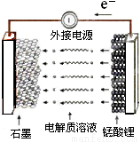 Li1-xMnO4 + LixC
Li1-xMnO4 + LixC LiMnO4 + C
LiMnO4 + C
下列有关说法正确的是
A.充电时电池内部Li+向正极移动
B.放电过程中,电能转化为化学能
C.放电时电池的正极反应式为:Li1-xMnO4+xe—+xLi+=LiMnO4
D.充电时电池的正极应与外接电源的负极相连
(1)酸性 ,NH4++H2O NH3·H2O+H+ (2)B C
NH3·H2O+H+ (2)B C
(3)2NO2(g)+CH4(g)=N2(g)+CO2(g)+2H2O(l);△H= -955kJ/mol
(4)①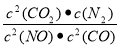 ;减小 ② D (5)C
;减小 ② D (5)C
【解析】
试题分析:(1)取某PM2.5样本,用蒸馏水处理,测得溶液中含有的离子有:K+、Na+、NH4+、SO42-、NO3-、Cl-,则由于K+、Na+、SO42-、NO3-、Cl-都是强酸或强碱的离子,而NH4+则是弱碱根离子。含有强酸弱碱盐。弱碱根离子水解消耗水电离产生的OH-,使溶液显酸性。其原因用离子方程式解释是为NH4++H2O NH3·H2O+H+。(2)SO2溶于水发生反应:SO2+H2O=H2SO3. H2SO3是酸,电离产生大量的H+而使溶液显酸性。所以应该用碱性物质氨水、Ca(OH)2悬浊液来吸收。因此选项为B、C。(3)根据题意可得该反应的热化学方程式为2NO2(g)+CH4(g)=N2(g)+CO2(g)+2H2O(l);△H= -955kJ/mol。(4)①根据化学平衡常数的含义可得该反应平衡常数表达式K=
NH3·H2O+H+。(2)SO2溶于水发生反应:SO2+H2O=H2SO3. H2SO3是酸,电离产生大量的H+而使溶液显酸性。所以应该用碱性物质氨水、Ca(OH)2悬浊液来吸收。因此选项为B、C。(3)根据题意可得该反应的热化学方程式为2NO2(g)+CH4(g)=N2(g)+CO2(g)+2H2O(l);△H= -955kJ/mol。(4)①根据化学平衡常数的含义可得该反应平衡常数表达式K=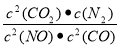 。由于该反应的正反应为放热反应。根据平衡移动原理:温度升高,化学平衡向吸热反应方向移动,对该反应来说升高温度,化学平衡向逆向移动,所以K值减小。②若该反应在绝热、恒容的密闭体系中进行。a.在反应刚开始时,由于温度变化不明显。主要是浓度的影响。随着反应的进行,气体的温度逐渐升高,影响化学反应速率的主要因素是温度。所以化学反应速率逐渐加快;当反应进行到一定程度后,反应物的浓度是影响化学反应速率的主要因素。由于反应物不断消耗,浓度减小,所以速率又逐渐减小。跟反应是否达到平衡无关。错误。B.在刚开始时反应刚发生,还未达到平衡,所以不能说平衡常数。当反应达到平衡后,升高温度,化学平衡逆向移动,K减小。但是从图像并未看出这一点来。错误。C若t点反应达到平衡,则各种反应混合物的浓度不应该发生变化。但是图像显示的c(CO)及c(CO2)任然在变化,因此反应为达到平衡。错误。d.在反应开始时,由于反应是从正反应方向开始,NO的质量最大,质量分数也最大,随着反应的减小,NO不断消耗。其质量分数也逐渐减小,当反应达到平衡后各种物质的质量、物质的量不变,所以其质量分数也不变。正确。(5)A.根据同种电荷相互排斥,异种电荷相互吸引的原则,充电时电池内部Li+向负极移动。错误。B.放电过程中,化学能转化为电能。错误。C.放电时电池正极发生还原反应。正极反应式为:Li1-xMnO4+xe—+xLi+=LiMnO4。正确。D.充电时电池的正极应与外接电源的正极相连。错误。
。由于该反应的正反应为放热反应。根据平衡移动原理:温度升高,化学平衡向吸热反应方向移动,对该反应来说升高温度,化学平衡向逆向移动,所以K值减小。②若该反应在绝热、恒容的密闭体系中进行。a.在反应刚开始时,由于温度变化不明显。主要是浓度的影响。随着反应的进行,气体的温度逐渐升高,影响化学反应速率的主要因素是温度。所以化学反应速率逐渐加快;当反应进行到一定程度后,反应物的浓度是影响化学反应速率的主要因素。由于反应物不断消耗,浓度减小,所以速率又逐渐减小。跟反应是否达到平衡无关。错误。B.在刚开始时反应刚发生,还未达到平衡,所以不能说平衡常数。当反应达到平衡后,升高温度,化学平衡逆向移动,K减小。但是从图像并未看出这一点来。错误。C若t点反应达到平衡,则各种反应混合物的浓度不应该发生变化。但是图像显示的c(CO)及c(CO2)任然在变化,因此反应为达到平衡。错误。d.在反应开始时,由于反应是从正反应方向开始,NO的质量最大,质量分数也最大,随着反应的减小,NO不断消耗。其质量分数也逐渐减小,当反应达到平衡后各种物质的质量、物质的量不变,所以其质量分数也不变。正确。(5)A.根据同种电荷相互排斥,异种电荷相互吸引的原则,充电时电池内部Li+向负极移动。错误。B.放电过程中,化学能转化为电能。错误。C.放电时电池正极发生还原反应。正极反应式为:Li1-xMnO4+xe—+xLi+=LiMnO4。正确。D.充电时电池的正极应与外接电源的正极相连。错误。
考点:考查PM2.5样本的水溶液的酸碱性及原因、热化学方程式的书写、温度对化学平衡常数的影响、化学平衡常数的表达式、化学平衡状态的判断、电化学反应原理的知识。


 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源:2013-2014学年山东省枣庄市高三下学期第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列叙述Ⅰ和Ⅱ均正确且有因果关系的是( )
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
B | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
C | SiO2与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
D | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年天津市七校高三4月联考理综化学试卷(解析版) 题型:选择题
常温下,用0.1000 mol·L-1 NaOH溶液分别滴定20.00 mL 0.1000 mol·L-1 盐酸和20.00 mL 0.1000 mol·L-1醋酸溶液,得到两条滴定曲线,如下图所示,若以HA表示酸,下列说法正确的是
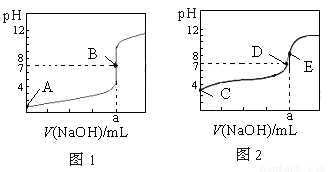
A.滴定盐酸的曲线是图2
B.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
C.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A-)
D.当0 mL<V(NaOH)<20.00 mL时,对应混合液中各离子浓度大小顺序为c(A-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市通州区高三年级模拟考试(一)理综化学试卷(解析版) 题型:填空题
碱式氯化铝[ Al2(OH)nCl6-n ] 是利用工业铝灰和活性铝矾土为原料(主要含Al、Al2O3、SiO2及铁的氧化物)经过精制加工而成,此产品活性较高,对工业污水具有较好的净化效果。其制备流程如下:
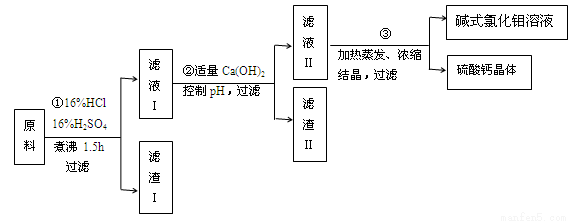
(1)原料需要粉碎,其目的是 ;滤渣I的主要成分是 ;
(2)步骤①在煮沸过程中,溶液逐渐变为浅绿色,此时溶液中呈浅绿色的阳离子常采用加入 试剂进行检验(填化学式);随后溶液又变为棕黄色,相关反应的离子方程式为 ;
(3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成碱式氯化铝;二是 ;已知碱式氯化铝的分散质粒子大小在1~100 nm之间,则区别滤液I与碱式氯化铝两种液体的物理方法是 ;若Ca(OH)2溶液过量,则步骤③得到的碱式氯化铝产率偏低,该反应的离子方程式为 ;
(4)某温度下若0.1 mol AlCl3溶于蒸馏水,当有2.5%水解生成Al(OH)3溶液时,吸收热量Q kJ ,该过程的热化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市通州区高三年级模拟考试(一)理综化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
A.电解饱和食盐水:2Cl-+ 2H2O 2OH-+ H2↑+ Cl2↑
2OH-+ H2↑+ Cl2↑
B.醋酸除去水垢中的CaCO3:CaCO3 + 2H+=Ca2+ + H2O + CO2↑
C.漂白粉溶液在空气中失效:ClO-+ CO2 + H2O=HClO + HCO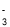
D.向NaHSO4溶液中滴加NaHCO3溶液:HSO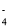 + HCO
+ HCO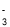 = H2O + SO
= H2O + SO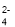 + CO2↑
+ CO2↑
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市房山区高三一模理综化学试卷(解析版) 题型:选择题
下列离子方程式的书写与结论均合理的是
选项 | 离子方程式 | 结论 |
A | AgCl(s) + I-( aq) | 溶解度:AgI > AgCl |
B | Fe2++ H2O2 +2H+= Fe3++2H2O | 氧化性:H2O2 > Fe3+ |
C | CO32- + CO2 + H2O = 2HCO3- | 稳定性:HCO3- > CO32- |
D | NH3 + H3O+ = NH4+ + H2O | 得质子能力:NH3 > H2O |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市丰台区高三下学期统一练习(一)化学试卷(解析版) 题型:填空题
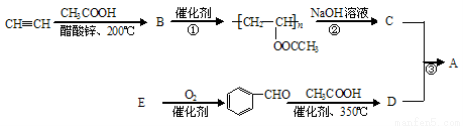
聚乙烯醇肉桂酸酯(A)可用于光刻工艺中做抗腐蚀涂层。下面是一种合成该有机物的路线:
已知: 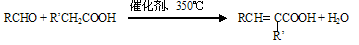
请回答:
(1)CH3COOH中的含氧官能团的名称为 ;其电离方程式是______。
(2)反应①是加聚反应,B的结构简式是 。
(3)反应②的反应类型是 。
(4)E的分子式为C7H8O,符合下列条件的E的同分异构体的结构简式是 。
① 能与浓溴水反应产生白色沉淀 ②核磁共振氢谱有4种峰
(5) 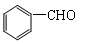 能与新制的Cu(OH)2反应,该反应的化学方程式是 。
能与新制的Cu(OH)2反应,该反应的化学方程式是 。
(6)关于D的性质下列说法正确的是 (填字母)。
a.存在顺反异构
b.溶液呈酸性,能与Na和NaOH溶液反应
c.能使KMnO4(H+)溶液和Br2(CCl4)溶液褪色
d.能发生银镜反应、酯化反应、加成反应和消去反应
(7)反应③的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:选择题
向硫酸铝铵溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是
A.NH4+ + SO42— + Ba2+ +OH—  BaSO4↓+ NH3·H2O
BaSO4↓+ NH3·H2O
B.2Al3+ + 3SO42— +3Ba2+ +6OH— 3BaSO4↓+ 2Al(OH)3↓
3BaSO4↓+ 2Al(OH)3↓
C.Al3+ + 2SO42— + 2Ba2+ + 4OH— 2BaSO4↓+ AlO2— + 2H2O
2BaSO4↓+ AlO2— + 2H2O
D.NH4++Al3+ +2SO42— +2Ba2+ +4OH— 2BaSO4↓+ Al(OH)3↓+ NH3·H2O
2BaSO4↓+ Al(OH)3↓+ NH3·H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:选择题
在试管中注入某红色溶液,给试管加热,溶液颜色逐渐变浅,则原溶液可能是
A.滴有酚酞的Na2CO3溶液 B.溶有SO2的品红溶液
C.滴有石蕊的CH3COOH溶液 D.滴有酚酞的饱和氢氧化钙溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com