
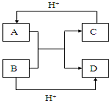
 已知A、B、C、D是中学化学中常见的四种10电子微粒,它们之间存在如图中转化关系.
已知A、B、C、D是中学化学中常见的四种10电子微粒,它们之间存在如图中转化关系.分析 10电子微粒A、B反应得到两种10电子微粒,应是NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O(或HF+OH-═F-+H2O),可推知A为NH4+,B为OH-,C为NH3,D为H2O(或A为HF,B为OH-,C为F-,D为H2O).
解答 解:10电子微粒A、B反应得到两种10电子微粒,应是NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O或HF+OH-═F-+H2O,可推知A为NH4+,B为OH-,C为NH3,D为H2O(或A为HF,B为OH-,C为F-,D为H2O),
故答案为:HF(或NH4+);H2O.
点评 本题考查无机物推断,主要考查离子反应的结构特征,熟记10电子微粒和18电子微粒及其性质.


科目:高中化学 来源: 题型:选择题
| A. | 钠的还原性很强,能被多种氧化剂氧化 | |
| B. | 钠的化学性质非常活泼,在自然界中钠元素以化合态存在 | |
| C. | 钠是一种灰黑色固体 | |
| D. | 钠的质地软,可用小刀切割 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将集有气体样品的试管倒扣于水槽中,试管中液面上升,则原气体样品中不一定含NH3 | |
| B. | 将带火星的木条伸入盛满气体样品的集气瓶中,木条未复燃,则原气体样品中一定不含O2 | |
| C. | 将一定体积气体样品缓缓通入澄清石灰水中,未见有白色沉淀,则原气体样品中一定不含CO2 | |
| D. | 将一定体积气体样品缓缓通入水中,恰好完全反应生成一种盐,向所得盐溶液中加入澄清石灰水,未见沉淀生成,则原气体样品中V(NH3):V(O2)=4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Fe2+(KSCN溶液) | B. | Cl-(稀硝酸酸化的AgNO3溶液) | ||
| C. | NH${\;}_{4}^{+}$(NaOH溶液) | D. | SO${\;}_{4}^{2-}$(先加HCl,再加BaCl2溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通式为CnH2n的烃一定能使酸性高锰酸钾溶液褪色 | |
| B. | 通式为CnH2n-2的烃一定是炔烃 | |
| C. | 分子式为C4H8的烃不一定能使溴水褪色 | |
| D. | 芳香烃的通式为CnH2n-6(n≥6) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 某化学兴趣小组为探究电化学原理,设计了如图装置(铁、铜为电极,烧杯中盛装硫酸铜溶液).下列叙述不正确的是( )
某化学兴趣小组为探究电化学原理,设计了如图装置(铁、铜为电极,烧杯中盛装硫酸铜溶液).下列叙述不正确的是( )| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铁片上发生的反应为:Fe-3e-=Fe3+ | |
| C. | 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 | |
| D. | a和b分别连接直流电源正、负极,Cu2+向铜电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫 | |
| B. | 铜与浓硫酸反应产生二氧化硫,而锌与浓硫酸反应产生氢气 | |
| C. | 二氧化硅是酸性氧化物能和烧碱溶液反应 | |
| D. | 在常温下,浓硫酸不与铜反应,是因为铜被钝化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com