
| A. | 发生化学反应时,失去电子越多的金属原子,其还原能力越强 | |
| B. | 目前已发现118种元素,即已发现118种原子 | |
| C. | 核外电子总数相同的粒子,必定是同种元素的原子 | |
| D. | 同一元素的各种同位素的化学性质基本相同 |
分析 A、发生化学反应时越容易失去电子的金属原子,还原能力越强;
B、一种元素可能含有多种同位素;
C、构成物质的粒子包括分子、原子和离子,有些分子和原子的质子数可能相同;
D、元素的化学性质与原子的价电子有关.
解答 解:A、金属原子的还原能力强弱取决于发生化学反应失去电子的难易程度,和失电子的多少无关,故A错误;
B、同一元素可能含有不同的核素(即原子),导致元素的种类小于原子的种类,所以发现118种元素,不等于发现118种原子,故B错误;
C、质子数相同的粒子,不一定是同种元素的原子,如水分子和氖原子的质子数相同,不能说是同种元素的原子,故C错误;
D、元素的化学性质与原子的最外层电子有关,同一元素的各种同位素核外电子数相同,所以它们的化学性质相同,但物理性质不同,故D正确.
故选D.
点评 本题考查了元素的金属性、同位素、核外电子数等知识点,难度不大,注意金属的金属性强弱与失电子难易程度有关,与失电子多少无关.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
 ,该化合物属于离子化合物.
,该化合物属于离子化合物.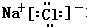 、
、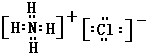 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常状况下,氨气的溶解度较大 | |
| B. | 氨水中的NH3•H2O电离出少量的OH- | |
| C. | 溶于水的氨气生成的少量NH3•H2O全部电离生成OH- | |
| D. | 氨气本身的碱性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加CO的浓度 | B. | 加压 | C. | 分离出硫 | D. | 加催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NiMH 电池放电过程中,正极的电极反应式为:NiOOH+H2O+e-=Ni(OH)2+OH- | |
| B. | 充电过程中OH-离子从阳极向阴极迁移 | |
| C. | 充电过程中阴极的电极反应式:H2O+M+e-=MH+OH-,H2O中的H被M还原 | |
| D. | 放电是OH-离子从正极向负极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤>②>①>③>④ | B. | ⑤>④>③>②>① | C. | ⑤>②>①>④>③ | D. | ②>①>⑤>④>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和② | B. | ②和③ | C. | ①和③ | D. | ③和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com