
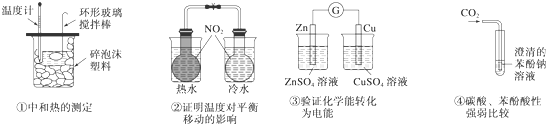
| A、①③ | B、②④ | C、①④ | D、②③ |


科目:高中化学 来源: 题型:
| A、CO2在反应中是还原剂 |
| B、每摩尔Na2O2完全反应时转移电子1mol |
| C、反应中O2既是氧化产物,又是还原产物 |
| D、上述反应可用于潜水艇中提供氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定 次数 | 待测混合溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 27.46 | 25.90 |
| 第三次 | 25.00 | 0.32 | 26.31 | 25.99 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、R为前四周期元素,且原子序数依次增大.常温下X的氢化物XH3溶于水PH>7;Y是地壳里含量最多的金属元素,其单质与酸碱均能反应;Z2有毒,其水溶液有漂白性;R基态原子3d轨道的电子数是4S轨道的电子数的3倍,RZ2溶液呈浅绿色.回答下列问题:
X、Y、Z、R为前四周期元素,且原子序数依次增大.常温下X的氢化物XH3溶于水PH>7;Y是地壳里含量最多的金属元素,其单质与酸碱均能反应;Z2有毒,其水溶液有漂白性;R基态原子3d轨道的电子数是4S轨道的电子数的3倍,RZ2溶液呈浅绿色.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水,然后将所得溶液分别置于A、B试管中. | 固体物质全部完全溶解 |
| 步骤2:向A试管中滴加适量BaCl2溶液. | a.如果 b.如果 |
| 步骤3: | 有白色沉淀生成,C的成分有NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
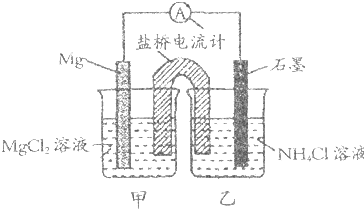
| A、石墨电极反应式为2NH4++2e-=2NH3↑+H2↑ |
| B、乙烧杯中一直存在:c(Cl-)<c(NH4+) |
| C、电子流向是由石墨→导线→Mg |
| D、盐桥中的Cl-移向乙烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏法是除去水中杂质得到纯净的水的最好方法 |
| B、用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 |
| C、用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
| D、用加热、蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| 气体 | CO2 | H2 | CO | H2O |
| 浓度(mol/L) | 0.1 | 0.9 | 0.3 | 0.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图在下衬白纸的玻璃片中央放置适量的KMnO4颗粒,在周围分别滴加一滴KBr溶液,品红溶液,含有酚酞的澄清石灰水,FeC12溶液,然后在KMnO4晶体上滴加适量的浓盐酸,迅速盖好表面皿.提示:实验室中所用的少量氯气可以用下述原理制取:
如图在下衬白纸的玻璃片中央放置适量的KMnO4颗粒,在周围分别滴加一滴KBr溶液,品红溶液,含有酚酞的澄清石灰水,FeC12溶液,然后在KMnO4晶体上滴加适量的浓盐酸,迅速盖好表面皿.提示:实验室中所用的少量氯气可以用下述原理制取:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com