
��16�֣�̼��ơ���������ѧ��ѧʵ���еij����Լ���
��1����ͬѧ��ⶨCaCO3���������0.1 mol��L��1 HCl�ķ�Ӧ���ʡ�
�� �÷�Ӧ�Ļ�ѧ����ʽΪ_________��
�� �������ʵ�鷽����
����һ��ͨ������_________��__________���㷴Ӧ����
��������ͨ������_________��__________���㷴Ӧ����
�� ����250mL 0.1 mol��L��1 HCl����ȡ___________mL 10 mol��L��1 HCl�����ձ��У�����������ˮ�����裬����Һת��__________�У�ϴ�ӣ����ݣ�ҡ�ȡ�
��2����ͬѧ������ͼװ��̽�����������ͷ�Ӧ��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�졣

��ѡ�Լ�����Ʒ��0.1 mol��L��1 HCl������״CaCO3����ĩ״CaCO3������ˮ����Ͳ�����
�� ���ʵ�鷽�����ڹ���������Ӧ��Ũ�Ȳ�ͬ�������£��ⶨ________��Ҫ������õ�������ֱ�����ַ�Ӧ���ʴ�С����
�� �ⶨʵ�������������ʵ�鷽���������������Զ����г������Լ����������������������ⶨ�����ݣ����ݿ�����ĸa��b��c�ȱ�ʾ��
������ ʵ����� | V��0.1mol/L HCl��/mL | ���� | ʵ��Ŀ�ģ�ʵ��1��2̽�����������Է�Ӧ���ʵ�Ӱ�죻ʵ��1��3̽����Ӧ��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�� | |
ʵ��1 | ���� | |||
ʵ��2 | ���� | |||
ʵ��3 | ���� |
��1����CaCO3��2HCl��CaCl2��H2P��CO2�� ������CO2��������������ͷ�Ӧʱ�䣻����CaCO3����������ͷ�Ӧʱ�� ��2.5 250ml ��2�������ɵ�����CO2�����ʱ�䣨����ͬʱ�������ɵ�CO2������
��
������ ʵ����� | V��0.1mol/L HCl��/mL | m(����״CaCO3)/g | m(��ĩ״CaCO3)/g | V(����ˮ)/ml | m(CO2)/g | ��Ӧʱ ��t/s |
ʵ��1 | a | b | 0���� | c | d | |
ʵ��2 | a | 0���� | b | c | d | |
ʵ��3 | c | b | 0���� | a | D |
��
������ ʵ����� | V��0.1mol/L HCl��/mL | m(����״CaCO3)/g | m(��ĩ״CaCO3)/g | V(����ˮ)/ml | ��Ӧʱ ��t/s | m(CO2) /g |
ʵ��1 | a | b | 0���� | c | d | |
ʵ��2 | a | 0���� | b | c | d | |
ʵ��3 | c | b | 0���� | a | D |
��������
�����������1����̼��������ᷴӦ�����Ȼ��ơ�ˮ��CO2����Ӧ�ķ���ʽΪCaCO3��2HCl��CaCl2��H2O��CO2����
��Ҫ���㷴Ӧ���ʣ������ͨ����������CO2��������������ͷ�Ӧʱ���������CaCO3����������ͷ�Ӧʱ�䣻
������250mL 0.1 mol��L��1 HCl��Ҫ10mol/LŨ����������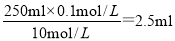 ������250ml��Һ��Ҫ250ml����ƿ��
������250ml��Һ��Ҫ250ml����ƿ��
��2�����ڹ���������Ӧ��Ũ�Ȳ�ͬ�������£�ͨ���ⶨ���ɵ�����CO2�����ʱ�䣨����ͬʱ�������ɵ�CO2����������ֱ�����ַ�Ӧ���ʴ�С����
��ʵ��1��2̽�����������Է�Ӧ���ʵ�Ӱ�죬��ʵ���й��������Dz�ͬ�ģ�����ľ�����ͬ�ġ�ʵ��1��3̽����Ӧ��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬��Ӧ��Ũ���Dz�ͬ�ģ����������ͬ�ģ���
������ ʵ����� | V��0.1mol/L HCl��/mL | m(����״CaCO3)/g | m(��ĩ״CaCO3)/g | V(����ˮ)/ml | m(CO2)/g | ��Ӧʱ ��t/s |
ʵ��1 | a | b | 0���� | c | d | |
ʵ��2 | a | 0���� | b | c | d | |
ʵ��3 | c | b | 0���� | a | D |
��
������ ʵ����� | V��0.1mol/L HCl��/mL | m(����״CaCO3)/g | m(��ĩ״CaCO3)/g | V(����ˮ)/ml | ��Ӧʱ ��t/s | m(CO2) /g |
ʵ��1 | a | b | 0���� | c | d | |
ʵ��2 | a | 0���� | b | c | d | |
ʵ��3 | c | b | 0���� | a | D |
���㣺���鷴Ӧ�����Լ���������Է�Ӧ����Ӱ��ʵ�鷽�������̽��


 ����ѧ��ţ��Ӣ��ϵ�д�
����ѧ��ţ��Ӣ��ϵ�д� ��ѧ�̸̳����¿α�ϵ�д�
��ѧ�̸̳����¿α�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ��ˮ�и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ij������Һ(���ܺ���Br����SO42����H2SO3��NH4+)�ֱ��������ʵ�飺�ټ���ʱ�ų����������ʹƷ����Һ��ɫ���ڼӼ�������Ժ���ʱ�ų����������ʹʪ��ĺ�ɫʯ����ֽ�������ۼ�����ˮʱ����Һ���Ի�ɫ���ټ���BaCl2��Һʱ�������İ�ɫ����������ϡ���ᡣ�����������ʲ���ȷ��������Һ���Ƿ���ڵ���
A��Br�� B��SO42�� C��H2SO3 D��NH4+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ������ѧ��12��������ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ��������þ��ͭ�Ͻ���뵽ϡ�����У�����ǡ����ȫ��Ӧ�����跴Ӧ�����л�ԭ����ȫ��NO����������Һ�м������ʵ���Ũ��Ϊ3mol/LNaOH��Һ��������ȫ��������ɳ�����������ԭ�Ͻ����������5.1 g���������й���������ȷ����
A������Ͻ����������Ϊ9.6g
B��������ȫʱ����NaOH��Һ���Ϊ150mL
C���μӷ�Ӧ����������ʵ���Ϊ0.4mol
D���ܽ�Ͻ�ʱ����NO�������0.224L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ӱ�ʡ������ѧ�ڵڶ����������ۻ�ѧ�Ծ��������棩 ���ͣ������
�ۻ�ѧ��ѡ��3�����ʽṹ�����ʣ�(15��)
��֪A��B��C��D��E����Ԫ�ص�ԭ������������������Aԭ����������������������������ԭ��������ȣ�Bԭ�Ӻ��������6�ֲ�ͬ���˶�״̬��s�����������p�����������������Dԭ��L���Ӳ�����2�ԳɶԵ��ӣ�E��ԭ�Ӻ�����3������Ҹ��������ȫ��״̬��
����д���пհס�
��1��EԪ�ػ�̬ԭ�ӵĺ�������Ų�ʽΪ_________________��
��2��B��C��D����Ԫ�صĵ�һ��������ֵ��С�����˳��Ϊ________����Ԫ�ط��ţ�����ԭ��Ϊ______��
��3��B2A4����Ҫ�Ļ���ʯ�ͻ���ԭ�ϡ�B2A4������Bԭ�ӹ�����ӻ�����Ϊ__________��1 mol B2A4�����к�__________mol�Ҽ���
��4����֪D��E���γɾ�����ͼ��ʾ�����ֻ����������Ļ�ѧʽ����Ϊ__________����Ϊ_____________������ʱ������ת��Ϊ�ҵ�ԭ��Ϊ__________________��
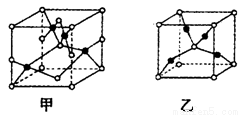
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ӱ�ʡ������ѧ�ڵڶ����������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
һ���¶��£�����ǿ����ʵı�����Һ�д����ų����ܽ�ƽ�⣬��ƽ�ⳣ��Ϊ
���� | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp��25�棩 | 8.0��10��16 | 2.2��10��20 | 4.0��10��38 |
���ں�Fe2(SO4)3��FeSO4��CuSO4��0.5mol�Ļ����Һ1L�������ϱ������жϣ�˵���������
A��������Һ����μ���NaOH��Һ�����ȿ������ɫ����
B������Һ�м���˫��ˮ������CuO��ĩ����pH�����˺�ɻ�ϴ�����CuSO4��Һ
C������Һ��c��SO42������[c��Fe3+��+c��Fe2+��+c��Cu2+��]=5��4
D��������FeCl3��ĩ���뺬Cu(OH) 2������Һ�У�����c��Cu2+������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��㶫ʡ�����и���1��ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
Ԫ��R��X��T��Z��Q��Ԫ�����ڱ��е����λ�����±���ʾ������ֻ��X�Ƕ����ڵĽ���Ԫ�أ������ж���ȷ����
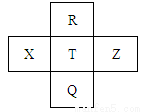
A��X�����������������ǿ��
B���ǽ����ԣ�T��R
C����̬�⻯���ȶ��ԣ�T��Z
D��R��Q��ԭ�Ӻ�����������16
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ��ˮ�и���һ�ָ�ϰ����֪ʶ��⻯ѧ�Ծ��������棩 ���ͣ������
��15�֣���������һ����������Ѫ�ܼ�����ҩ����ɻ�����E��M��һ�������ºϳɵõ������ַ�Ӧ�����ԣ���
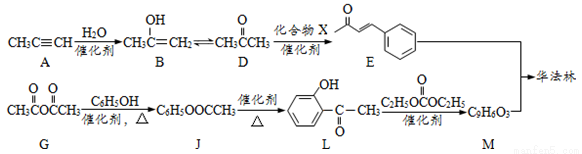
��1��A������Ϊ__________________��A��B�ķ�Ӧ����Ϊ_____________________
��2��D��E�ķ�Ӧ�У�����Ļ�����X������Cu (OH)2��Ӧ����ש��ɫ�����Ļ�ѧ����ʽΪ____________________________________________________________
��3��G��JΪȡ����Ӧ������һ������ӵĽṹ��ʽΪ__________________
��4��L�����������ͬ���칹����______�֣�L��ͬ���칹��Q�Ƿ����ᣬQ�����з�Ӧ
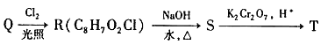
�õ�T��T�ĺ˴Ź�������ֻ������壬��Q�Ľṹ��ʽΪ ��R��S�Ļ�ѧ����ʽΪ____________________________
��5����֪��L��M��ԭ��Ϊ���� �͢�
�͢�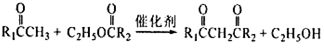 ��M�Ľṹ��ʽΪ ��
��M�Ľṹ��ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ��ˮ�и���һ�ָ�ϰ����֪ʶ��⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ����ȷ����
A����SO2����ͨ��NaClO��Һ�У�SO2+2ClO��+H2O=SO32��+2HClO
B����FeBr2��Һ��ͨ�����Cl2��2Fe2++4Br��+2Cl2=2Fe3++2Br2+4Cl��
C�������������Һ�м���Ba(OH)2��Һ�����ԣ�2H++SO42��+Ba2++2OH��=BaSO4��+2H2O
D��NH4HCO3��Һ�����NaOH��Һ��Ӧ��NH4++OH��=NH3��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ��ԭ�и�һ��ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����ƻ����Ͷ��������ˮ�У���ַ�Ӧ�õ�������Һ�����ռ���4.48 L H2(��״��)�����Ƶ����ʵ���Ϊ0.1 mol�����������ʵ���Ϊ
A. 0.1 mol B. 0.2 mol
C. 0.05 mol D. 0.025 mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com