

 +Br2$\stackrel{催化剂}{→}$
+Br2$\stackrel{催化剂}{→}$ +HBr.
+HBr.分析 由制备实验装置可知,三颈瓶中苯与液溴发生取代反应生成溴苯和HBr,D中四氯化碳除去苯和溴,E中硝酸银溶液检验HBr,E中出现浅黄色沉淀可说明AgBr的生成,最后NaOH吸收尾气,三颈烧瓶的粗苯进一步分离提纯得到溴苯,以此来解答.
解答 解:由制备实验装置可知,三颈瓶中苯与液溴发生取代反应生成溴苯和HBr,D中四氯化碳除去苯和溴,E中硝酸银溶液检验HBr,E中出现淡黄色沉淀可说明沉淀为AgBr,最后NaOH吸收尾气,三颈烧瓶的粗苯进一步分离提纯得到溴苯,
(1)关闭F活塞,打开C活塞,在装有少量苯的三颈瓶中由A口加入少量溴,再加入少量铁屑,塞住A口,则三颈瓶中发生反应的化学方程式为 +Br2 $\stackrel{催化剂}{→}$
+Br2 $\stackrel{催化剂}{→}$ +HBr,故答案为:
+HBr,故答案为: +Br2 $\stackrel{催化剂}{→}$
+Br2 $\stackrel{催化剂}{→}$ +HBr;
+HBr;
(3)由上述分析可知,E试管内装的是AgNO3溶液,E试管内出现的现象为导管口产生大量的白雾、溶液中生成淡黄色沉淀,
故答案为:AgNO3溶液;导管口产生大量的白雾、溶液中生成淡黄色沉淀;
(4)待三颈烧瓶中的反应即将结束时(此时气体明显减少),打开F活塞,关闭C活塞,因HBr极易溶于水,可以看到的现象是水倒吸至三颈烧瓶中,
故答案为:水倒吸至三颈烧瓶中.
点评 本题考查溴苯的制备实验,为高频考点,把握有机物的制备实验原理、实验装置的作用、反应与现象为解答的关键,侧重分析与实验能力的考查,注意HBr的性质及检验,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 胶体是很稳定的分散系,比溶液还稳定 | |
| B. | 胶体能发生丁达尔现象 | |
| C. | 胶体的分散质不能透过滤纸 | |
| D. | 胶体不稳定,静止后容易产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前我国流通的硬币是由合金材料制成的 | |
| B. | Al与S直接化合可以得到Al2S3,则Fe与S直接化合也可以得到Fe2S3 | |
| C. | 黄铜耐腐蚀性强,不能与稀盐酸反应 | |
| D. | 某金(Au)合金的组成可表示为CuAu3.,其中金为-3价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:Cl>Br | B. | 金属性:Al>Mg | ||
| C. | 热稳定性:H2O>H2S | D. | 酸性:H3PO4>H3AsO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把NaHCO3和Na2CO3混和物6.85g溶于水制成100mL溶液,其中c(Na+)=1mol•L-1.该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量无法计算 | |
| B. | 将54.4g铁粉和氧化铁的混合物中加入4.0mol/L 200mL的稀硫酸,恰好完全反应,放出氢气4.48L(标准状况).反应后的溶液中滴加KSCN不显红色,且无固体剩余物,反应后得到FeSO4的物质的量是0.8mol | |
| C. | 现向一密闭容器中充入1molN2和3molH2,在一定条件下使该反应发生,达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
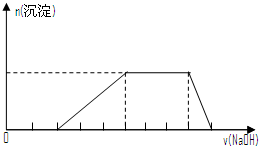
| D. | 某溶液中可能含有H+、Na+、NH${\;}_{4}^{+}$、Mg2+、Fe3+、Al3+、SO${\;}_{4}^{2-}$等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、NH${\;}_{4}^{+}$、Mg2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
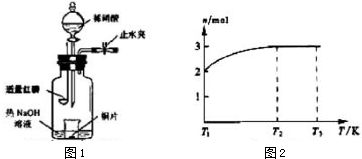
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 三氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+ | |
| D. | 金属钠跟水反应:2Na+2H2O=2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ”分别表示不同元素的原子.下列各项中对图示模型理解正确的是( )
”分别表示不同元素的原子.下列各项中对图示模型理解正确的是( )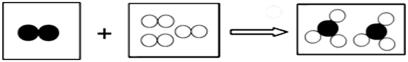
| A. | 该反应属于分解反应 | |
| B. | 反应中共有两种元素参与 | |
| C. | 反应物和生成物中只有一种单质 | |
| D. | 参加反应的两种物质分子个数之比为2:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com