
| A、平衡前,随着反应的进行,容器内气体密度逐渐减小 |
| B、平衡时,该反应放出的热量为Q kJ |
| C、平衡后,再向容器中通入1mol 氦气,A的转化率增大 |
| D、平衡后,缩小容器体积,A的浓度增大 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、构成物质的分子中一定含有化学键. |
| B、离子化合物可能含有共价键 |
| C、共价化合物可能含有离子键 |
| D、离子化合物中一定含有金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Li | B、Na | C、K | D、Rb |
查看答案和解析>>
科目:高中化学 来源: 题型:
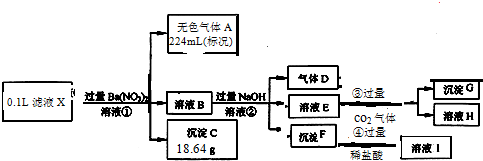
| 原溶液中确定含有的阴离子的化学式 | 该阴离子的物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
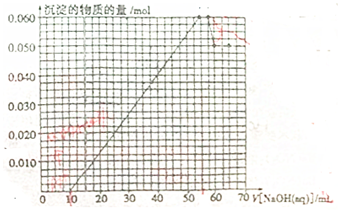
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
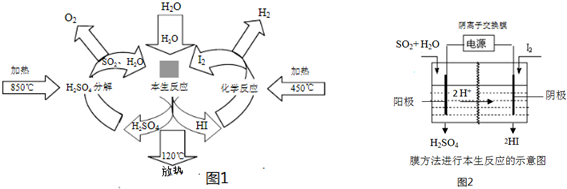
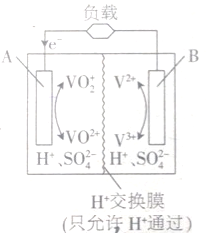 (1)B电极为电池的
(1)B电极为电池的查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3- | H2SO4 | O2- | 35Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2、NH3的水溶液都能够导电,因此都属于电解质 |
| B、电解饱和食盐水的过程中,水的电离平衡逆向移动 |
| C、任何一个氧化还原反应都可以设计为电池,输出电能 |
| D、若两种不同的核素具有相同的中子数,则二者一定不属于同种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙酸、甲苯、硝基苯 |
| B、苯、苯酚水溶液、酒精水溶液 |
| C、乙醛、乙酸乙酯、溴苯 |
| D、淀粉粉末、蔗糖粉末、石蕊粉末 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com