
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)═c(H+)+c(CH3COOH) | |
| D. | 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
分析 A.根据溶液的电中性原则分析;
B.从盐对应的酸越弱,水解程度越大分析;
C.根据混合液中的电荷守恒和物料守恒分析;
D.0.1mol•L-1的NaHA溶液,其pH=4,则说明HA-以电离为主.
解答 解:A.溶液遵循电中性原则,根据电荷守恒可得:c(H+)+c(M+)═c(OH-)+c(A-),故A正确;
B.pH相等,溶液中的c(OH-)相等,根据酸性越弱,水解越强,所以溶液中c(Na2CO3)<c(CH3COONa),故B错误;
C.根据混合液中的电荷守恒得:c(H+)+c(Na+)=c(OH-)+c(CH3COO-)…①,
根据物料守恒可得:2c(Na+)=c(CH3COO-)+c(CH3COOH)…②,
将①×2-②得:c(CH3COO-)+2c(OH-)═2c(H+)+c(CH3COOH),故C错误;
D.NaHA溶液的pH=4,溶液呈酸性,即c(H+)>c(OH-),同时也可以判断HA-以电离为主,所以离子浓度的大小顺序是:c(HA-)>c(H+)>c(A2-)>c(H2A),故D错误;
故选A.
点评 本题考查离子浓度的大小比较,题目难度中等,注意从电荷守恒、物料守恒、结合盐类的水解和弱电解质的电离程度解答该题,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 磷单质及其化合物在工业上有广泛应用.磷最重要的矿物资源是磷灰石,磷灰石主要有氟 磷灰石和羟基磷灰石.氟磷灰石在高温下制备白磷的化学方程式为:4Ca5 (P04)3F+21Si02+30C═3P4+20CaSi03+30CO+SiF4,结合上述反应中涉及到的物质或元素回答相关问题:
磷单质及其化合物在工业上有广泛应用.磷最重要的矿物资源是磷灰石,磷灰石主要有氟 磷灰石和羟基磷灰石.氟磷灰石在高温下制备白磷的化学方程式为:4Ca5 (P04)3F+21Si02+30C═3P4+20CaSi03+30CO+SiF4,结合上述反应中涉及到的物质或元素回答相关问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
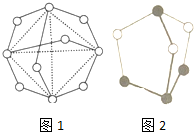
 已知化合物A(C4Si4H8)分子结构为正六面体,其结构如图所示:则C4Si4H8的二氯代物的同分异构体数目为( )
已知化合物A(C4Si4H8)分子结构为正六面体,其结构如图所示:则C4Si4H8的二氯代物的同分异构体数目为( )| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只需加热 | B. | 水、氢氧化钠溶液、加热蒸发 | ||
| C. | 水、盐酸、加热蒸发 | D. | 水、氢氧化钙、过滤、蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2属于大气污染物 | |
| B. | 酸雨是PH小于7的雨水 | |
| C. | 硅酸钠溶液应保存在带玻璃塞的试剂瓶中 | |
| D. | 大气中CO2含量的增加会导致温室效应加剧 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 甲醇可以与水蒸气反应生成氢气,反应方程式如下:
甲醇可以与水蒸气反应生成氢气,反应方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4 | B. | Na2O2 | C. | Fe(OH)3 | D. | AlCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com