��2013?���죩�Ͻ��ǽ�������ĸ����������ϣ�
��1����ĸ�������������Ͻ����죮
����Ԫ�������ڱ��е�λ����
�������ڵڢ�A��
�������ڵڢ�A��
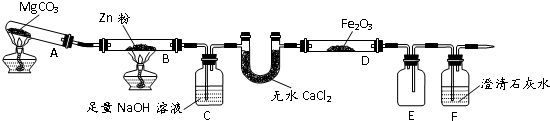
����ҵ������ԭ������������ȡ���ã���ȡ������ͨ�������Ϊ
CO2
CO2
��
��Al-Mg�Ͻ�ǰ��NaOH��Һ����Al
2O
3Ĥ���仯ѧ����ʽΪ
Al2O3+2NaOH=2NaAlO2+H2O
Al2O3+2NaOH=2NaAlO2+H2O
�����ӹ�����ʹ�õı�����Ϊ
Ar
Ar
���ѧʽ����
��2����ĸ�������Ϊ�Ͻ�֣�
�ٽ����ں�ˮ�з����ĵ绯ѧ��ʴ��ҪΪ
������ʴ
������ʴ
��
�ں�ĸ�øֿ��ɵ�����ұ�����ɣ���������������Ϊ���躬������������Ϊ
CaCO3��CaO
CaCO3��CaO
��
��3����ĸ��������Ҫ��ͭ�Ͻ����죮
��80.0g Cu-Al�Ͻ�������ȫ�ܽ���������ˮ�����˵õ���ɫ����39.0����Ͻ���Cu����������Ϊ
83.1%
83.1%
��
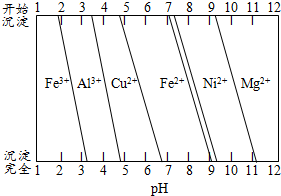
��Ϊ����ijͭ�Ͻ�ijɷ֣����Ὣ����ȫ�ܽ����NaOH��Һ����pH����pH=3.4ʱ��ʼ���ֳ������ֱ���pHΪ7.0��8.0ʱ���˳������������ͼ��Ϣ�ƶϸúϽ��г�ͭ��һ������
Al��Ni
Al��Ni
��

 ��2013?���죩�Ͻ��ǽ�������ĸ����������ϣ�
��2013?���죩�Ͻ��ǽ�������ĸ����������ϣ�