
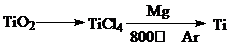
| ||
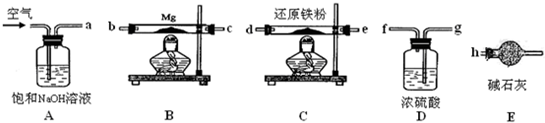
| ||
| ||


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
| A、乙烯和苯都能使溴水褪色,褪色的原因相同 |
| B、淀粉、蛋白质完全水解的产物互为同分异构体 |
| C、乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
| D、石油裂解和油脂皂化都有高分子生成小分子的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水和酒精 |
| B | 17.9 | 290 | 1.26 |
查看答案和解析>>
科目:高中化学 来源: 题型:
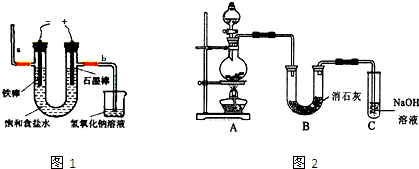
查看答案和解析>>
科目:高中化学 来源: 题型:
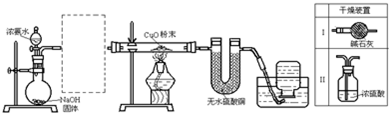
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
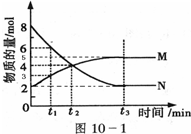 Ⅰ:下列各项分别与哪个影响化学反应速率因素的关系最为密切?
Ⅰ:下列各项分别与哪个影响化学反应速率因素的关系最为密切?查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com