
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu
2O/ZnO):CO(g)+2H
2(g)?CH
3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=
,升高温度,K值
减小
减小
(填“增大”、“减小”、“不变”).
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H
2)=
.(用上图中出现的字母表示)
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的
,下列有关该体系的说法正确的是
b、c
b、c
.
a.氢气的浓度减小 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H
2)/n(CH
3OH)增大
(4)据研究,反应过程中起催化作用的为Cu
2O,反应体系中含少量CO
2有利于维持催化剂Cu
2O的量不变,原因是:
Cu2O+CO?2Cu+CO2
Cu2O+CO?2Cu+CO2
(用化学方程式表示).
(5)能源问题是人类社会面临的重大课题,甲醇是未来的重要的能源物质.常温下,1g甲醇完全燃烧生成液态水时放出22.7kJ的能量,写出甲醇燃烧热的热化学方程式
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-726.4kJ/mol
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-726.4kJ/mol
.

 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g) 2Cu+CO2向正反应方向移动,维持Cu2O的量不变,
2Cu+CO2向正反应方向移动,维持Cu2O的量不变, 2Cu+CO2.
2Cu+CO2.

 名校课堂系列答案
名校课堂系列答案 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)CH3OH(g)根据题意完成下列各题:
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)CH3OH(g)根据题意完成下列各题: 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g),下列有关说法正确的是( )
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g),下列有关说法正确的是( )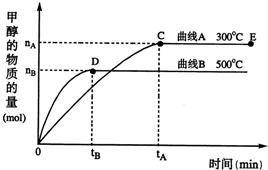 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO): CH3OH(g)
CH3OH(g) 2Cu+CO2
2Cu+CO2 2Cu+CO2
2Cu+CO2
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO).根据题意完成下列各题:
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO).根据题意完成下列各题: