
已知可逆反应:M(g)+N(g)![]() p(g)+Q(g),ΔH>0,在一密闭容器中进行.
p(g)+Q(g),ΔH>0,在一密闭容器中进行.
(1)在某温度下,反应物的起始浓度分别为:c(M)=1 mol/L,c(N)=2.4 mol/L;达到平衡后,M的转化率为60%,此时,求算该反应平衡常数K=________,N的转化率为________.
(2)若反应温度升高,M的转化率________(填“增大”“减小”或“不变”);
(3)若反应温度不变,保持容器体积不变,反应物的起始浓度分别为:c(M)=2 mol/L,c(N)=________mol/L;C(P)=2 mol/L,C(Q)=________mol/L,达到平衡后,各物质的百分含量与原平衡相同.
科目:高中化学 来源: 题型:
已知可逆反应:M(g)+N(g)![]() P(g)+Q(g);△H>0,
P(g)+Q(g);△H>0,
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1, c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为 。
(2)若反应温度升高,M的转化率 (填“增大”“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol·L-1,c(N)=amol·L-1;达到平衡后,c(P)=2 mol·L-1,a= 。
(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)= bmol·L-1,达到平衡后,M的转化率为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江西省白鹭洲中学高二下学期第三次月考化学试卷(带解析) 题型:填空题
(14分)I.A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应开始时,A、B的体积相同。已知:2NO2(g)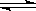 N2O4(g)△H<0。
N2O4(g)△H<0。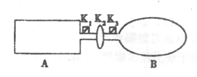
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是V(A) V(B)(填“<”、“>”或“=”);若打开活塞K2,气球B将 (填“变大”、“变小”或“不变”,下同)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率α(A)将 。
若通入等量的Ne气,则达到平衡时,A中NO2的转化率将 ,B中NO2的转化率将
(3)室温时,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时, 中的颜色较深。
(4)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的压强为原来的80%,试求出平衡时NO2的转化率 。
II.已知可逆反应:M(g)+N(g)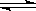 P(g)+Q(g);△H>0,请回答下列问题:①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
P(g)+Q(g);△H>0,请回答下列问题:①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
A、加入一定量M B、加入一定量N C、反应温度升高
D、缩小容器体积 E、加入某物质作催化剂 F、分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1,c(N)="2.4" mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为 。
③若反应温度不变,反应物的起始浓度分别为:c(M)=" 4" mol·L-1,c(N)=amol·L-1;达到平
衡后,c(P)="2" mol·L-1,a= mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2012届福建省芗城三校高三下学期第二次考试化学试卷(带解析) 题型:填空题
(共10分)
(1)已知可逆反应:M(g)+N(g)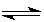 P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为_______________。
| A.加入一定量M | B.加入一定量N |
| C.反应温度升高 | D.缩小容器体积 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省芗城三校高三下学期第二次考试化学试卷(解析版) 题型:填空题
(共10分)
(1)已知可逆反应:M(g)+N(g) P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为_______________。
A.加入一定量M B.加入一定量N C.反应温度升高
D.缩小容器体积 E.加入某物质作催化剂 F.分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为_______________。此反应的化学平衡常数K=_______________。
③若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=_______________mol·L-1。
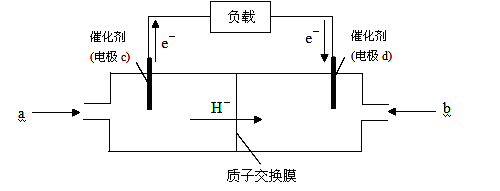
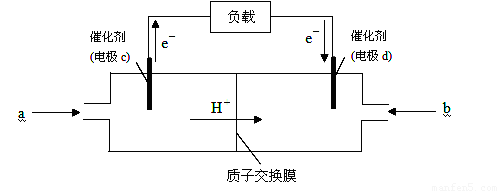
(2)随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求。
下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。甲醇在催化剂作用下提供质子和电子(电子转移的方向如下图所示),电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH+3O2===2CO2+4H2O。则c电极是 (填“正极”或“负极”),c电极上发生的电极反应式为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013届江西省高二下学期第三次月考化学试卷(解析版) 题型:填空题
(14分)I.A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应开始时,A、B的体积相同。已知:2NO2(g)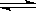 N2O4(g) △H<0。
N2O4(g) △H<0。
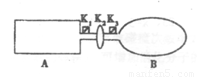
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是V(A) V(B)(填“<”、“>”或“=”);若打开活塞K2,气球B将 (填“变大”、“变小”或“不 变”,下同)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率α(A)将 。
若通入等量的Ne气,则达到平衡时,A中NO2的转化率将 ,B中NO2的转化率将
(3)室温时,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时, 中的颜色较深。
(4)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的压强为原来的80%,试求出平衡时NO2的转化率 。
II.已知可逆反应:M(g)+N(g)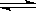 P(g)+Q(g);△H>0,请回答下列问题:①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
P(g)+Q(g);△H>0,请回答下列问题:①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
A、加入一定量M B、加入一定量N C、反应温度升高
D、缩小容器体积 E、加入某物质作催化剂 F、分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为 。
③若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol·L-1,c(N)=amol·L-1;达到平
衡后,c(P)=2 mol·L-1,a= mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com