
| A. | 该溶液的 pH=4 | |
| B. | 升高温度,溶液的 pH 增大 | |
| C. | 此酸的电离平衡常数约为 1×10-7 | |
| D. | 由 HA 电离出的 c(H+)约为水电离出的 c(H+)的106倍 |
分析 A.利用氢离子的浓度计算pH;
B.温度升高促进弱酸的电离;
C.根据电离度及离子的浓度计算电离平衡常数;
D.HA电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,根据Kw计算水电离的氢离子,再求出二者的关系.
解答 解:A.HA电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,则pH=-lg(10-4)=4,故A正确;
B.温度升高促进弱酸的电离,HA的电离程度增大,溶液中氢离子浓度增大,所以溶液的pH减小,故B错误;
C.由HA═H++Ac-,c(H+)=c(Ac-)=10-4mol/L,则电离平衡常数为$\frac{1{0}^{-4}×1{0}^{-4}}{0.1}$=1×10-7,故C正确;
D.HA电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,水电离的氢离子等于水电离的氢氧根离子为$\frac{1{0}^{-14}}{1{0}^{-4}}$=10-10mol/L,所以由HA 电离出的 c(H+)约为水电离出的 c(H+)的106倍,故D正确;
故选B.
点评 本题考查弱酸的电离,明确离子的浓度、温度对电离平衡的影响及离子积的计算即可解答,难度不大,侧重于考查学生的分析能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
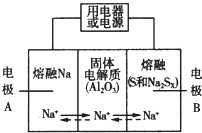 钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 夏日的傍晚常常看到万丈霞光穿云而过美不胜收 | |
| B. | 受伤时,在流血的伤口上抹一点FeCl3可以止血 | |
| C. | “尿毒症”患者做血液透析治疗 | |
| D. | 三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度不变,增大A的物质的量,化学平衡右移 | |
| B. | 温度不变,增大B的浓度,V正增大,V逆减小,化学平衡右移 | |
| C. | 温度不变,减小C的浓度,V逆减小,V正减小,化学平衡右移 | |
| D. | 温度不变,增大D的浓度,同时增大B的浓度,化学平衡一定向左移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种溶液中由水电离出来的c(H+)不相同 | |
| B. | 将两溶液等体积混合,则c(H+)>c(CH3COO-)═c(Cl-)>c(OH-) | |
| C. | 分别用蒸馏水稀释m倍和n倍,若两溶液pH仍相同,则m<n | |
| D. | 中和相同体积的两种酸溶液所需NaOH的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中存在CO32- | B. | 溶液中c(H+)•c(OH-)=10-14 | ||
| C. | 与等物质的量的NaOH恰好中和 | D. | 溶液中c(Na+)>c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 等浓度的三种溶液:醋酸钠溶液pH=a,碳酸氢钠溶液pH=b,碳酸钠溶液pH=c,则c>a>b | |
| B. | 在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液pH=7 | |
| C. | MgCl2溶液蒸发、结晶得MgCl2•6H2O | |
| D. | 常温下,若1mL pH=1盐酸与100mL NaOH溶液混合后,溶液pH=7,则NaOH溶液的pH=11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com