
 ��1�����й����в�һ���ͷ���������AB�������ţ�
��1�����й����в�һ���ͷ���������AB�������ţ����� ��1�����ȷ�Ӧ�ͷ������������ͷ�����˵�������ȷ�Ӧ���ݴ˷�����
��2��������������Խ�ߣ���Ӧ�ͷ�����Խ�ࣻ
��3�����ݾɼ��������յ�������ȥ�¼������ͷŵ�����ֵ��Ϊ��Ӧ�Ƚ��ȼ�շ�ӦΪ���ȷ�Ӧ��
��4���ټ�����Һ�и�����ӦΪ2H2-4e-+4OH-=4H2O��������ӦΪO2+4e-+2H2O=4OH-������ܷ�ӦΪ2H2+O2=2H2O��
�ڴӻ��ϼ۵ı仯�ĽǶȷ�����
�۸���ʵ�ʲμ����յ������Լ��缫��Ӧʽ���㣮
��� �⣺��1��A�����Ϸ�Ӧ���ȣ���C��CO2����CO�ķ�Ӧ�����ȷ�Ӧ����Aѡ��
B���ֽⷴӦ�������ȷ�Ӧ����Bѡ��
C���γɻ�ѧ�����ͷ���������C��ѡ��
D��ȼ��ȼ���ͷ���������D��ѡ��
E������кͷ�Ӧ�Ƿ��ȷ�Ӧ����E��ѡ��
F��ըҩ��ը���ȣ���F��ѡ���ʴ�Ϊ��AB��
��2��������������������������������ߣ���ȫȼ��ʱ���������ͷŵ������ߣ��ʴ�Ϊ��A��
��3��1molH2O�к�2molH-O�����Ͽ�1molH-H��1molO=O��1molO-H�������յ������ֱ�ΪQ1��Q2��Q3kJ�����1molO-H���ų�Q3kJ���������ڷ�ӦH2��g��+$\frac{1}{2}$O2��g��=H2O��g�����Ͽ�1 mol O=O����1 molH-O�������յ�����Q1+$\frac{1}{2}$Q2�������¼��ͷŵ�����2Q3���÷�Ӧ���ȣ�2Q3-��Q1+$\frac{1}{2}$Q2����0����2Q1+Q2��2Q3���ʴ�Ϊ��C��
��4���ٸ���Ϊʧȥ���ӵ�һ������H2ʧ��������H+��������Һ�Ǽ��Եģ��ʵ缫��Ӧʽ����Ӧ������OH-��������ӦΪ2H2-4e-+4OH-=4H2O��H2+2OH--2e-=2H2O��
�ʴ�Ϊ��2H2+4OH--4e-=4H2O��H2+2OH--2e-=2H2O��
��Li���������+1�ۣ�����ԭ����H2O��H��+1����H2�е���ۣ������������ʴ�Ϊ��H2O��
��Li����10mol H2����20mol LiH����20mol LiH������20mol H2��ʵ�ʲμӷ�Ӧ��H2Ϊ20mol��80%=16mol��1molH2ת����1molH2O��ת��2mol���ӣ�����16molH2��ת��32mol�ĵ��ӣ��ʴ�Ϊ��32��
���� ���⿼���˳����ķ��ȷ�Ӧ�����ȷ�Ӧ���ʱ��С�жϡ���ѧ��Դ�Ĺ���ԭ�����йؼ��㣬��Ŀ�ѶȽϴ�ע��ԭ��ص缫��Ӧʽ����д�Լ��ӵ����غ�ĽǶȼ��㣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | [X]=0.2mol/L��[Y]=0.6mol/L | B�� | [Y]=0.5mol/L | ||
| C�� | [X]=0.2mol/L��[Z]=0.4mol/L | D�� | [Z]=0.4mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��101kPaʱ��1mol������ȫȼ��ʱ���ų������������������ʵ�ȼ���� | |
| B�� | ��ͼ���кͷ�Ӧ����1molˮ����ʱ�ķ�Ӧ�Ƚ��к��� | |
| C�� | ȼ���Ȼ��к��ȶ��Ƿ�Ӧ�ȵ�����֮һ | |
| D�� | ��������һ��ʱ��������������Ӧ����Һ̬ˮ����̬ˮʱ���ų���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��� | ʵ��װ�� | ʵ��Ŀ�� |
| A | 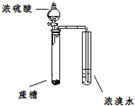 | ֤��Ũ���������ˮ�ԡ������� |
| B | 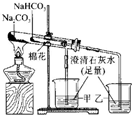 | �Ƚ�̼������̼�����ƹ�������ȶ��� |
C | 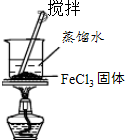 | ��ȡ������Fe��OH��3���� |
| D | 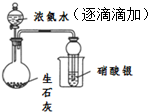 | ֤��Ũ��ˮ����ʯ�����ÿ��Ʊ��õ����� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
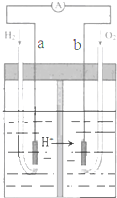
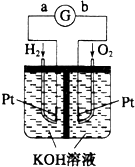
| A�� | a��������������a������b�� | |
| B�� | a���ĵ缫��Ӧʽ�ǣ�H2-2e-=2H+ | |
| C�� | ��ع���һ��ʱ���װ����c��H2SO4������ | |
| D�� | ����H2��Ϊ�����ʵ���CH4��O2���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������H2 C2O4���壬�ٽ�ˮ���룬��Һ��c��H+������ | |
| B�� | ����NaOH��Һ��ǡ����ȫ��Ӧ������Һ�У�c��Na+����c��C2O42-����c��HC2O4-����c��H+�� | |
| C�� | ���백ˮ�����ԣ�����Һ�У�c��NH4+��+c��Na+��=2c��C2O42-��+c��HC2O4-�� | |
| D�� | ����0.01 mol Na2C2O4���壬����Һ�У�3c��Na+��=2[c��H2C2O4��+c��HC2O4- ��+c��C2O42-��] |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
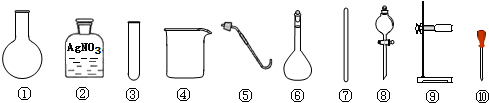
| A�� | ��ȥ�����еIJ��������ʣ�ѡ�� �ܢߢ�� | |
| B�� | ����A����Һ���Ƿ�SO42-��ѡ�� �ڢۢ� | |
| C�� | �����ᴿ���NaCl��������0.1mol/L����Һ��ѡ�� �ܢޢߢ� | |
| D�� | ��NaCl������ŨH2SO4�����Ʊ�HCl���壬ѡ�� �٢ݢ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������Ա������ᣨH2Sˮ��Һ������ǿ | |
| B�� | Cl2������Ӧ����FeCl3����S������Ӧ����FeS | |
| C�� | Cl2����H2S��Ӧ����S | |
| D�� | ��ԭ�ԣ�Cl-��S2- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
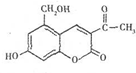
| A�� | �������ط���ʽΪC12H11O5�����ڳ��������� | |
| B�� | �������ؾ��������ԣ�˵���ǻ��Ա�����Ӱ�� | |
| C�� | 1mol���������������2molNaOH������Ӧ | |
| D�� | 1mol���������������5molH2�����ӳɷ�Ӧ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com