
氯仿(CHCl3)不溶于水,密度比水大,是一种良好的有机溶剂,因保存不当受光照易被氧化而产生剧毒光气(COCl2),反应为2CHCl3+O2![]() 2COCl2+2HCl.为防止中毒事故,使用前必须检查它是否被氧化.检验选用的试剂是________,实验现象和结论是________.
2COCl2+2HCl.为防止中毒事故,使用前必须检查它是否被氧化.检验选用的试剂是________,实验现象和结论是________.
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:高中化学必修2第一章《原子结构与元素周期律》单元测试卷 题型:022
麻醉剂的发现和使用,是人类医疗史上了不起的一项成就,它可使患者在接受治疗中感觉不到疼痛.
(1)一种常用的麻醉剂氯仿(CHCl3),常因保存不善而被氧化,产生剧毒物光气(COCl2).反应方程式为2CHCl3+O2![]() 2HCl+2COCl2.为防止发生事故,使用前可用于检验麻醉剂是否变质的试剂是(填序号)________.
2HCl+2COCl2.为防止发生事故,使用前可用于检验麻醉剂是否变质的试剂是(填序号)________.
A.淀粉碘化钾溶液
B.NaOH溶液
C.酚酞溶液
D.硝酸酸化的硝酸银溶液
(2)作为麻醉剂,疝气在医疗上很受重视,疝气能溶于细胞的油脂里,引起细胞麻醉和膨胀,从而神经末梢作用暂时停止.人们曾试用体积分数为80%疝气和20%的氧气组成的混合气体,作为无副作用的麻醉剂疝在元素周期表中位于________周期,________族,它的原子序数是________.
(3)作为稀有气体,氙的化学性质不活泼,但它可在一定条件下生成化合物.
取1 mol氙气和3.5 mol氟气于一密闭容器内充分反应,后来余下了1.5 mol的氟气同时有白色固体生成,此白色固体的化学式为________.
查看答案和解析>>
科目:高中化学 来源:北京市顺义区2011届高三二模理综化学试题 题型:022
甲烷是一种重要的基础化工原料,不仅可制备多种重要有机产品,还可用于环境保护.请回答下列问题
:(1)
用甲烷催化还原氮的氧化物可消除氮氧化物的污染.已知: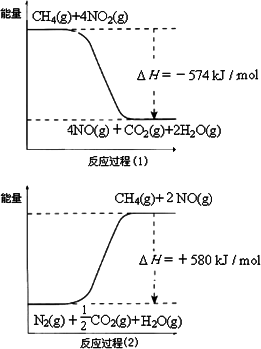
反应过程(2)是________反应(填“放热”或“吸热”),甲烷还原NO2生成H2O(g)、N2和CO2时的热化学方程式是________.
(2)工厂利用甲烷与氯气的反应原理制取氯甲烷,
为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应:CCl4(g)+H2(g) CHCl3(g)+HCl(g),
CHCl3(g)+HCl(g),
在固定容积为2 L的密闭容器中,该反应达到平衡后,测得如下数据:

①此反应在110℃时平衡常数为________.②实验1中,CCl4的转化率为________.
③判断该反应的正反应是________
(填“放热”或“吸热”),理由是_____________.④为提高实验3中CCl4的转化率,可采取的措施是________.
a.使用高效催化剂
b.向容器中再投入1 mol CCl4和1 mol H2
c.温度升高到200℃
d.向容器中再投入1 mol HCl
e.向容器中再投入1 mol H2
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题


查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
 CHCl3 +HCl 此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)。
CHCl3 +HCl 此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)。 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com