
����ͼʾ���Ӧ�������������
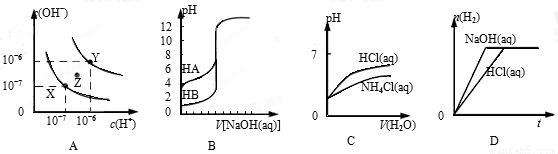
A����ʾ��ͬ������ˮ�ĵ���ƽ�����ߣ�ͼ�и����¶ȣ�X > Z > Y
B����ʾŨ����ͬ������һԪ��ֱ���0.1 mol/L NaOH��Һ�ζ����ߣ����ԣ�HA > HB
C����ʾpH��ͬ��NH4Cl��Һ��HCl��Һ�ֱ��ͬ���ˮϡ�Ͷ���pH�ı仯����
D����ʾ�������������ʵ���Ũ�ȵ������NaOH��Һ�зֱ�����������ۣ�����H2�����ʵ�����ʱ��ı仯����

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015�㶫ʡ�����и�һ��ѧ�ڵ�һ�νο�������ѧ�Ծ��������棩 ���ͣ�ѡ����
Ԫ�����ڱ������Ԫ�غͷǽ���Ԫ�طֽ��߸�����Ԫ�ؿ�������
A������ũҩ B���ư뵼�����
C������ҽ��ҩ�� D���Ƹ��ºϽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�㶫ʡ��ɽ�и߶���ѧ�ڵ�һ���¿�����ѧ�Ծ��������棩 ���ͣ�ѡ����
��8�����ʣ������飻����ϩ������Ȳ���ܱ����ݼױ�����һ�����飻�߾���ϩ�����ϩ�����мȲ���ʹ����KMnO4��Һ��ɫ��Ҳ��������ˮ��Ӧʹ��ˮ��ɫ����
A���٢ڢۢ� B���ܢޢߢ� C���٢ܢޢ� D���ڢۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�������и�����ѧ�ڵڶ�������������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
������Һ����Һ�У���������Ũ�ȵ�˵����ȷ����
A��һ��Ũ�ȵİ�ˮ��ˮϡ�͵Ĺ����У�c(NH4+)/ c(NH3��H2O)�ı�ֵ��С
B��Ũ�Ⱦ�Ϊ0.1 mol��L��1��Na2CO3��NaHCO3�����Һ�У�c(CO32��) > c(HCO3��)����2c(Na��)��3[c(CO32��)��c(HCO3��)]
C��0.2 mol��L��1�Ĵ��ᣨCH3COOH����Һ��0.1 mol��L��1 NaOH��Һ�������Ϻ�c(CH3COO��) + 2c(OH��) = c(CH3COOH) + 2c(H+)
D�������£���֪��Ksp(AgCl)��1.8��10��10��Ksp(Ag2Cr2O4)��2.0��10��12����Ag2CrO4����Һ�е�c(Ag��)һ��С��AgCl����Һ�е�c(Ag��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������к�����������ѧ���ܸ�ϰ��������һ���ۻ�ѧ�Ծ��������棩 ���ͣ������
��14�֣�̼���仯�����ڹ�ũҵ����������������Ҫ���á��밴Ҫ��ش��������⣺
��1����֪��C(s)+O2(g) = CO2(g) ��H = -393 kJmol-1��
2CO(g)+O2(g) = 2CO2(g) ��H = -566 kJmol-1��
2H2(g)+O2(g) = 2H2O(g) ��H = -484 kJmol-1
��ˮ�����絽���ȵ�̿�Ͽ�ʵ��̿���������Ƶ�CO��H2�����÷�Ӧ���Ȼ�ѧ����ʽΪ______________________________________________________________________��
��2����һ����CO(g)��H2O(g)�ֱ�ͨ���ݻ�Ϊ2 L�ĺ����ܱ������У�һ�������·�����ӦΪCO(g)+H2O(g)  CO2(g)+H2(g)���õ���������ʵ�����ݣ�
CO2(g)+H2(g)���õ���������ʵ�����ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | |
H2O | CO | CO2 | |||
1 | 500 | 4 | 8 | 3.2 | 4 |
2 | 750 | 2 | 4 | 0.8 | 3 |
3 | 750 | 2 | 4 | 0.8 | 1 |
�ٸ÷�Ӧ������ӦΪ (����ȡ����ȡ�)��Ӧ��
��ʵ��1�У�0��4 minʱ���ڣ���v(H2)��ʾ�ķ�Ӧ����Ϊ �����ڴ��¶���H2O(g)��CO(g)��ʼ���ֱ�Ϊ2 mol��4 mol����˷�Ӧ��ƽ�ⳣ��Ϊ___________��
��ʵ��2�ﵽƽ��ʱCO��ת����Ϊ ��
��ʵ��3��ʵ��2��ȣ��ı�������� ��
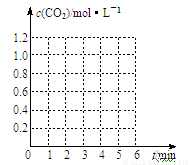
������ͼ�����л�����ʵ��2���롰ʵ��3����c(CO2)��ʱ��仯�����ߣ�������עʵ���š�
��3��CO��H2һ�������·�Ӧ���ɼ״���CH3OH�����״���һ��ȼ�ϣ������ü״����һ��ȼ�ϵ�أ���KOH��Һ���������Һ�����ʯī���缫���õ�صĸ�����ӦʽΪ____________________________________��
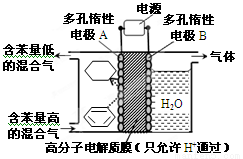
��4��һ�������£���ͼװ�ÿ�ʵ���л���ĵ绯ѧ���⣨���������л�����������ĵ缫��ӦʽΪ
______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������к�ƽ��������ѧ�ڵ�һ���������黯ѧ�Ծ��������棩 ���ͣ������
��14�֣�CH4��CO2��Ӧ���������ֵ���ߵĻ�ѧ��Ʒ��
��1��250��ʱ�������Ͻ�Ϊ��������4 L������ͨ��6 mol CO2��6 mol CH4��������Ӧ��CO2��g����CH4��g�� 2CO��g����2H2��g����ƽ����ϵ�и���ֵ�Ũ��Ϊ��
2CO��g����2H2��g����ƽ����ϵ�и���ֵ�Ũ��Ϊ��
�� �� | CH4 | CO2 | CO | H2 |
ƽ��Ũ�ȣ�mol��L-1�� | 0.5 | 0.5 | 2.0 | 2.0 |
�ٴ��¶���,�÷�Ӧ��ƽ�ⳣ��K=__________________��ע����λ����
����֪��CH4��g����2O2��g����CO2��g����2H2O��g�� ��H1��a kJ��mol��1
CO��g����H2O ��g����CO2��g����H2 ��g�� ��H2��b kJ��mol��1
2CO��g����O2��g����2CO2��g�� ��H3��c kJ��mol��1
��ӦCO2��g����CH4��g�� 2CO��g����2H2��g���ġ�H=________kJ��mol��1��
2CO��g����2H2��g���ġ�H=________kJ��mol��1��
��2����Cu2Al2O4��������������Ӧ: CO2+CH4  CH3COOH, ��ش�:
CH3COOH, ��ش�:
���¶�������Ĵ�Ч�ʺ����������������ͼ��
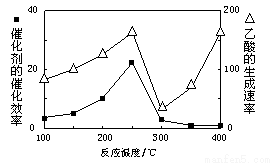
250��300��ʱ���¶����߶�������������ʽ��͵�ԭ���� ��
��Ϊ���������ӦCH4��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� ��д2�֣���
��Cu2Al2O4���ܽ���ϡ������,��������Ԫ��Ϊ ��ÿ����3mol Cu2Al2O4ʱ����ԭ��HNO3Ϊ mol��
��3��Li2O��Na2O��MgO��������CO2,
����Ѱ������CO2���������ʣ����н���������� ��
a�����ڼ�����������Ѱ��
b�����ھ���ǿ�����Ե�������Ѱ��
c�����ڢ�A����A��Ԫ�ص���������Ѱ��
��Li4SiO 4���������ա��ͷ�CO2, ԭ����: 500��ʱ��CO2��Li4SiO4�Ӵ�����Li2CO3��ƽ��������700�棬��Ӧ������У��ų�CO2��Li4SiO4��������ԭ���Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������к�ƽ��������ѧ�ڵ�һ���������黯ѧ�Ծ��������棩 ���ͣ�ѡ����
һ�����͵��Ҵ���أ����û����������ܼ�������ܷ�ӦΪ��C2H5OH +3O2 �� 2CO2 +3H2O,���ʾ������ͼ,����˵����ȷ����
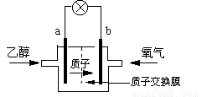
A��a��Ϊ��ص�����
B����ع���ʱ������a���ص��߾������ٵ�b��
C����ظ����ĵ缫��ӦΪ��4H+ + O2 + 4e�� = 2H2O
D����ع���ʱ,1mol C2H5OH������ʱ��12mol e��ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡμ���и�����ѧ������⣨һģ����ѧ�Ծ��������棩 ���ͣ������
(10�֣����������飬�׳���˪������ʽAs2O3�������ҵ��ֵ���黯���P��Ҫ���黯ѧ��ʼ���ϡ���Ҳ������ϵĶ���֮һ������ζ�����Ϊ��ɫ��״��ĩ���ʳ���˪��
��1����ɲ���ƽ���л�ѧ����ʽ:
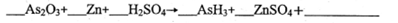
��2��As2O3��������Ӧ����ʾ������������_____________��
A�������� B����ԭ�� C������ D������
��3��������0��2molAsH3 ,��ת�Ƶ��ӵ����ʵ���Ϊ___________mol��
��4���黯��AsH3��һ�ֺ�ǿ�Ļ�ԭ�����������������ڿ�������ȼ�����������������ԣ�д���÷�Ӧ�Ļ�ѧ����ʽ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ��У�����ڶ����������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��NA��ʾ�����ӏ�������ֵ������˵����ȷ����
A�����³�ѹ�£�2.24L ���������������������Һ��ȫ��Ӧת�Ƶĵ�����Ϊ0.1NA
B��25��ʱ��2L0.1mol/L��Na2CO3��Һ�к��е�CO32-����Ϊ0.2 NA
C��ij�ܱ�������ʢ��0.2molSO2��0.1molO2����һ�������³�ַ�Ӧ������SO3������Ϊ0.2 NA
D��30g����ͼ�ȩ�Ļ��������ԭ����ΪNA
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com