
| A. | 二氧化硅 | B. | 保鲜膜 | C. | 青花瓷 | D. | 金刚石 |
科目:高中化学 来源: 题型:选择题
| A. | 1 mol氧气中含有1.204×1024个氧原子,在标准状况下占有体积22.4 L | |
| B. | 1 mol臭氧和1.5 mol氧气含有相同的氧原子数 | |
| C. | 当He、H2、O2三种气体的温度和密度都相同时,它们的压强大小是p(O2)>p(He)>p(H2) | |
| D. | 等物质的量的干冰和葡萄糖(分子式为C6H12O6)中所含碳原子数之比为1:6,氧原子数之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将含硫酸的废液倒入水槽,用水冲入下水道 | |
| B. | 对医用酒精进行蒸馏操作可得到更高纯度的酒精溶液 | |
| C. | 加热高锰酸钾固体制取并收集氧气结束后,应立即停止加热 | |
| D. | 蒸馏实验时,冷水应从上口进下口出 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 瓦斯中甲烷和氧气的质量比为1:4时极易爆炸,此时甲烷与氧气的体积比为1:2 | |
| B. | 欲配制1.00 L1.00 mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 | |
| C. | 22.4LN2和H2的混合气体中含NA个原子 | |
| D. | 3mol单质Fe完全转变为Fe3O4,得到8NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 9 | C. | 12 | D. | 15 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
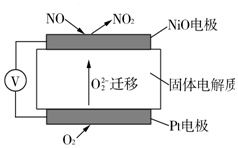
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
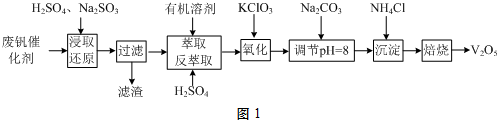
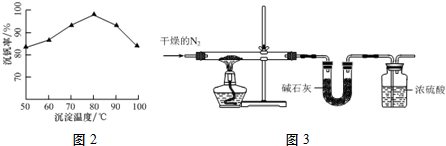
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com