
X、Y、Z均为短周期主族元素,其核电荷数依次增大,且它们的原子最外层电子数之比为1∶4∶2。下列叙述中正确的是( )
A.X一定是碱金属元素
B.Y元素能形成化合物NaHYO3,且其水溶液呈碱性
C.Z元素形成的最高价氧化物熔点较低
D.X的单质一定能通过电解Z的盐酸盐溶液制备
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
判断正误,正确的打“√”,错误的打“×”
(1)在晶体中只要有阴离子就一定有阳离子( )
(2)在晶体中只要有阳离子就一定有阴离子( )
(3)原子晶体的熔点一定比金属晶体的高( )
(4)分子晶体的熔点一定比金属晶体的低( )
(5)离子晶体一定都含有金属元素( )
(6)金属元素和非金属元素组成的晶体不一定是离子晶体( )
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)氯酸钾熔化,粒子间克服了________的作用力;二氧化硅熔化,粒子间克服了________的作用力;碘的升华,粒子间克服了________的作用力。三种晶体的熔点由高到低的顺序是____________(填化学式)。
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为________(填序号)。
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子是________,由非极性键形成的非极性分子是________,能形成分子晶体的物质是________,含有氢键的晶体的化学式是________________________,属于离子晶体的是____________________,属于原子晶体的是____________________,五种物质的熔点由高到低的顺序是________________。
(4)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:
A.________________;B.________________;
C.________________;D.________________。
(5)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/℃ | 1 266 | 1 534 | 183 |
试解释上表中氟化物熔点差异的原因:_____________________________________。
(6)镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。150 ℃时,Ni(CO)4分解为Ni和CO。Ni(CO)是________晶体,Ni(CO)4易溶于下列________(填序号)
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)质子数为35、中子数为45的溴原子: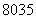 Br( )
Br( )
(2014·江苏,2B)
(2)硫离子的结构示意图: ( )
( )
(2014·江苏,2C)
(3)核外电子排布相同的微粒化学性质也相同( )
(2014·山东理综,8B)
(4)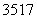 Cl与
Cl与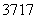 Cl得电子能力相同( )
Cl得电子能力相同( )
(2014·山东理综,8D)
(5)氯原子的结构示意图: ( )
( )
(2013·江苏,2C)
(6)中子数为146、质子数为92的铀(U)原子: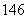 92U( )
92U( )
(2013·江苏,2D)
(7)原子核内有18个中子的氯原子: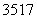 Cl( )
Cl( )
(2012·海南,9D)
(8)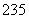 92U和
92U和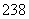 92U是中子数不同质子数相同的同种核素( )
92U是中子数不同质子数相同的同种核素( )
(2012·天津理综,3C)

(9)元素周期表中铋元素的数据见右图,则:
①Bi元素的质量数是209( )
②Bi元素的相对原子质量是209.0( )
(2012·上海,6改编)
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素的一个原子形成的离子可表示为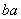 Xn-,下列说法正确的是 ( )
Xn-,下列说法正确的是 ( )
A.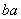 Xn-含有的中子数为a+b
Xn-含有的中子数为a+b
B.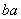 Xn-含有的电子数为a-n
Xn-含有的电子数为a-n
C.X原子的质量数为a+b+n
D.1个X原子的质量约为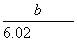 g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F、G、L、I九种主族元素分别位于三个不同的短周期,它们的原子序数依次增大,其中B、C、D位于同一周期,A与E、B与G、D与L分别位于同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F最外层电子数的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)以上元素中非金属所形成的最简单气态氢化物稳定性最弱的是(填化学式)__________________________,E、F、L所形成的简单离子的半径由大到小的顺序为(用离子符号表示)____________。
(2)L、I两元素可按原子个数比1∶1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为__________________________________________。
(3)固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生,写出该反应的离子方程式:_______________________。
(4)由A、B、C、D按原子个数比4∶1∶1∶2形成一种化合物Y,则Y的化学式为________________________,向Y中加足量稀硫酸后,再加高锰酸钾溶液,高锰酸钾溶液褪色。写出使高锰酸钾溶液褪色的反应的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活密切相关,下列说法正确的是( )
A.蛋白质和油脂都是天然高分子化合物
B.CO2和CH4都是造成温室效应的气体
C.蔗糖和麦芽糖的水解产物均为葡萄糖
D.苯酚和甲苯遇FeCl3均显紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
NA代表阿伏加德罗常数,在含4 g NaOH溶质的溶液中通入一定量的CO2,将溶液蒸干并灼烧,最后得到的固体可能是( )
A.0.1NA的NaHCO3
B.0.05NA Na2CO3
C.0.05NA~0.1NA Na2CO3和NaHCO3混合物
D.0.1NA的NaHCO3和NaOH混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com