
【题目】实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是①__________(填序号),配制上述溶液还需用到的玻璃仪器是②____________(填仪器名称)。
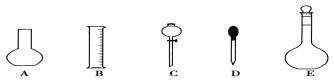
(2)根据计算用托盘天平称取NaOH的质量为③ g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度④__________0.1 mol·L-1(填“大于”、“等于”或“小于”)。
(3)由计算知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为__⑤__mL(计算结果保留一位小数)。如果实验室有15 mL、20 mL、50 mL量筒,应选用__⑥__mL量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是将浓硫酸沿烧杯壁缓缓倒入水中,并用玻璃棒不断搅拌。
【答案】(1) ①A、C; ②烧杯、玻璃棒;(2) ③2.0;④小于;(3)⑤13.6; ⑥15.
【解析】
试题分析:实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500mL,(1)如图所示的仪器中配制溶液肯定不需要的是①A和C,②配制溶液出要用到题目中所给的仪器外,还需要用到的仪器有玻璃棒和烧杯,答案为:①A、C ②烧杯、玻璃棒;(2)配制0.1 mol·L-1 NaOH溶液450 mL,需要选用的容量瓶为500mL,所以需要用托盘天平称取氢氧化钠的质量为0.1mol/L×0.5L×40g/mol=2.0g,在实验中其他操作均正确,若定容时仰视刻度线,液面的最低处高于刻度线,相当于增大了所配溶液的体积,所以所配溶液的物质的量浓度小于0.1mo l·L-1,答案为:③2.0 ④小于;(3)0.5 mol·L-1硫酸溶液500mL,需要H2SO4的质量为:0.5mol/L×0.5L×98g/mol=24.5g,需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为(24.5g/98%)÷1.84 g·cm-3=13.6mL,应该选用15mL的量筒量取,答案为:⑤13.6 ⑥15


科目:高中化学 来源: 题型:
【题目】体操运动员在完成单杠、吊环项目时常用“镁粉”搓手,以起到防滑效果。某种“镁粉”中可能含有Mg、MgO、Mg(OH)2、MgCO3中的一种或两种固体,实验小组对其成分展开了探究。
已知:MgO+2HCl=MgCl2+H2O MgCO3+2HCl=MgCl2+H2O+CO2↑
(1)探究“镁粉”中是否含有Mg和MgCO3
①取少量样品,如图所示进行实验。观察到a试管中有气泡产生,b试管中产生的现象是澄清石灰水变浑浊,则证明“镁粉”中一定含有______。

②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭。但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成浓NaOH溶液,目的是______________。小明按照修改后的实验方案重复上述实验,观察到b试管中无明显现象,证明“镁粉”中______________。
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验。分别取0.5g三种固体粉末,每次取样方法如图2所示:

逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失。在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
MgO | Mg(OH)2 | MgCO3 | |
消耗稀盐酸的体积 /mL | 10.4 | 7.2 | 5.0 |
Mg(OH)2与盐酸发生中和反应的化学方程式为_____________。
Ⅱ.取“镁粉”样品0.5 g,加入上述稀盐酸至粉末恰好溶解。此时消耗稀盐酸的体积约为5.3 mL。
【实验分析及结论】
“镁粉”不只含有MgCO3。理由是____________________________________。
【实验反思】
为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5 g“镁粉”和0.5 g_________,加入足量稀盐酸,测定生成的气体体积分别为119mL和140mL。由此可知“镁粉”中含有MgCO3的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属, K是一种红棕色气体。
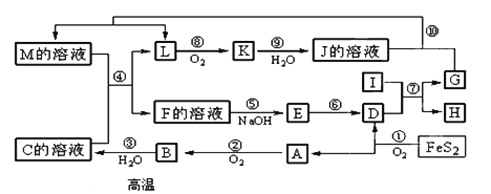
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第____________周期_________族。
(2) 在反应⑦中氧化剂与还原剂的物质的量之比为___________________。
(3)在②、③、⑥、⑨中既属于化合反应又属于非氧化还原反应的是___________(填序号)
(4) 反应④的离子方程式是:__________________________________。
(5) 将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾), 同时还生成KNO2和H2O。该反应的化学方程式是:
_________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的说法中正确的是( )。
A.二氧化锰能加快所有化学反应的速率
B.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
C.100 mL 2 mol·L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率变小
D.对于任何反应,增大压强都可加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如右图所示:
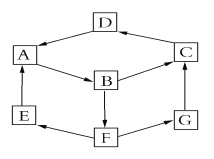
已知①A、B、C、D、G含有同种元素。
②
纯A(单质) | B溶液 | D固体 | G溶液 | |
颜色 | 银白色 | 黄色 | 红棕色 | 浅绿色 |
③E是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,也能将一种氧化物氧化为F,F是含有三种元素的化合物,与A反应生成E、G。
依据以上信息填空:
(1)写出D的化学式: 。
(2)G生成C的过程中所出现的现象为 写出对应的离子方程式
(3)写出反应A→B的化学方程式: 。
(4)B→F的离子方程式为 ;G与次氯酸反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如右表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
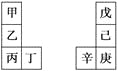
A. 金属性:甲>乙>丁
B. 最高价氧化物水化物酸性:戊<己
C. 丙与庚的原子核外电子数相差13
D. 乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com