解:Ⅰ①闻气体的气味时,用手轻轻在瓶口扇动,仅使极少量的氯气飘进鼻孔,故①正确;
②用天平称量应遵循“左物右码”,将食盐放在右盘中的纸片上称取10.4g时,若1g以下用游码,实际称量氯化钠为10g-0.4g=9.6g,故②错误;
③溶液配制最后需加水定容,容量瓶洗涤后未进行干燥,不影响所配溶液的浓度,故③正确;
④溶液变成浅红色,且30内颜色不褪去,说明滴定到终点,故④错误;
⑤测定溶液的pH时,用洁净、干燥的玻璃棒蘸取待测溶液,点在试纸中部,待变色后与标准比色卡对照读数,故⑤正确;
⑥过氧化钠能与二氧化碳、水反应,可能发生危险,剩余的过氧化钠粉末应回收在专门的容器内,故⑥错误.
故选①③⑤.
Ⅱ(1)在食盐水里氯化钠完全电离,水分子是微弱电离的,因而存在着Na
+、H
+、Cl
-、OH
-四种离子.
当接通直流电原后,带负电的OH
-和Cl
-移向阳极,带正电的Na
+和H
+移向阴极.
在这样的电解条件下,
在阳极,Cl
-比OH
-容易失去电子被氧化成氯原子,氯原子两两结合成氯分子放出.
2Cl
--2e
-=Cl
2↑(氧化反应),
在阴极,H+比Na+容易得到电子,因而H+不断从阴极获得电子被还原为氢原子,氢原子两两结合成氢分子从阴极放出.
2H
++2e
-=H
2↑ (还原反应),
由于H
+在阴极上不断得到电子而生成氢气放出,破坏了附近的水的电离平衡,水分子继续电离成H
+和OH
-,H
+又不断得到电子,结果溶液里OH
-的数目相对地增多了,因而阴极附近形成了氢氧化钠的溶液.电解饱和食盐水的总的化学方程式可以表示如下:2NaCl+2H
2O

2NaOH+H
2↑+Cl
2↑,故答案为:2NaCl+2H
2O

2NaOH+H
2↑+Cl
2↑;
(2)A为阴极,产生的氢气中含有水蒸气,通入Y试剂中进行干燥,再通入CuO粉末来测定Cu的相对原子质量,减少误差;B为阳极,产生的氯气通入X试剂中验证氯气的氧化性;所以A连E,B连C,故答案为:E;C;
(3)试剂X为了验证氯气的氧化性,可选择具有还原性的物质,且反应现象明显,可选择淀粉碘化钾溶液,通入氯气,溶液由无色变为蓝色,说明氯气与碘化钾反应生成碘,氯气为氧化剂,表现氧化性;电解饱和食盐水产生的氢气中含有水蒸气,会影响铜的相对原子质量的测定,需进行干燥,丙装置中Y试剂是为了吸收氢气中的水,故答案为:淀粉KI溶液;吸收氢气中的水;
(4)如选方案甲数据进行计算时,主要考虑两方面原因会导致测定Cu的相对原子质量偏大或偏小,U形管中的干燥剂也可能吸收空气中的水和CO
2,导致测定结果偏大,得到Cu的相对原子质量偏低;
根据质量守恒定律和题给氧化铜质量及方案乙所测数据,
设Cu的相对原子质量为x,由反应前后氧元素的质量是不变的,
得等式为:w×

=c-d
解得:x=
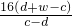
所以按较佳方案计算,得到Cu的相对原子质量是
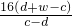
,故答案为:乙;
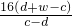
;
分析:Ⅰ①闻气体的气味时,用手轻轻在瓶口扇动,仅使极少量的氯气飘进鼻孔;
②用天平称量应遵循“左物右码”;
③溶液配制最后需加水定容,容量瓶洗涤后未进行干燥,不影响所配溶液的浓度;
④溶液变成浅红色,且30内颜色不褪去,说明滴定到终点;
⑤测定溶液的pH时,用洁净、干燥的玻璃棒蘸取待测溶液,点在试纸中部,待变色后与标准比色卡对照读数;
⑥过氧化钠能与二氧化碳、水反应.
Ⅱ①电解饱和食盐水,Cl
-在阳极失电子产生氯气,H
+在阴极得电子产生氢气,H
+不断得到电子,结果溶液里OH
-的数目相对地增多了,因而阴极附近形成了氢氧化钠的溶液.电解饱和食盐水的总的化学方程式可以表示如下:2NaCl+2H
2O

2NaOH+H
2+Cl
2↑;
②A为阴极,产生的氢气通入E试剂中干燥,再通入CuO粉末来测定Cu的相对原子质量;B为阳极,产生的氯气通入X试剂验证氯气的氧化性;
③试剂X为了验证氯气的氧化性,可选择具有还原性的物质,且反应现象明显;丙装置中Y试剂是为了吸收氢气中的水,减少误差;
④选方案一的数据进行计算时,主要考虑U型管也可能吸收空气中的CO
2或澄清石灰水也可能未吸收完生成的CO
2两方面原因会导致测定Cu的相对原子质量偏大或偏小;
选用了方案二数据进行计算是利用反应前后CuO中氧元素的减少量和实验前准确称取CuO的质量为wg中氧元素的质量相等,求得Cu的相对原子质量.
点评:本题考查实验基本操作,题目难度中等,注意利用实验测定数据进行计算,要排出诸多影响测定结果的干扰.


 2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑; =c-d
=c-d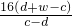
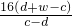 ,故答案为:乙;
,故答案为:乙;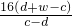 ;
; 2NaOH+H2+Cl2↑;
2NaOH+H2+Cl2↑;
