
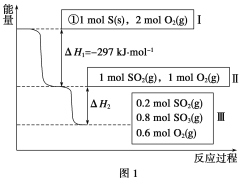
【题目】恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示
[已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1]:
2SO3(g) ΔH=-196.6 kJ·mol-1]:
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:____________________。
(2)ΔH2=_____________________。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比|ΔH2|________(填“大”、“小”或“相等”)。
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为__________,若溶液中发生了氧化还原反应,则该过程的离子方程式为______________________。
(5)向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2 和1 mol O2;(乙) 1 mol SO2 和0.5 mol O2;(丙) 2 mol SO3;恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A.容器内压强p:p甲=p丙>2p乙
B.SO3的质量m:m甲=m丙>2m乙
C.c(SO2)与c(O2)之比k:k甲=k丙>k乙
D.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
(6)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是__________;图中表示平衡混合物中SO3的含量最高的一段时间是____________。
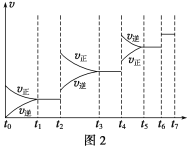
(7)各阶段平衡时对应的平衡常数如下表所示:
t1~t2 | t3~t4 | t5~t6 | t6~t7 |
K1 | K2 | K3 | K4 |
K1、K2、K3、K4之间的关系为__________________。
【答案】
(1)S(s)+O2(g)=SO2(g) ΔH=-297 kJ·mol-1
(2)-78.64 kJ·mol-1;
(3)大(4)2 mol;2SO2+O2+4OH-=2SO![]() +2H2O
+2H2O
(5)B;(6)升高温度;t3~t4(7)K4=K3<K2=K1
【解析】
试题分析:(1)燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,所以,硫的物质的量为1mol.由图1可知1molS(s)完全燃烧放出的热量为297KJ,所以,硫的燃烧热的热化学方程式S(s)+O2(g)═SO2(g)△H=-297 KJmol-1,故答案为:S(s)+O2(g)═SO2(g)△H=-297 KJmol-1;
(2)由由图1可知,参加反应的n(SO2)=1mol-0.2mol=0.8mol,根据热化学方程式:2SO2(g)+O2(g) ![]() 2SO3(g)△H=-196.6KJmol- 1;可知,△H2=0.4△H=0.4×(=-196.6KJmol- 1)=-78.64KJmol-1.故答案为:-78.64KJmol-1
2SO3(g)△H=-196.6KJmol- 1;可知,△H2=0.4△H=0.4×(=-196.6KJmol- 1)=-78.64KJmol-1.故答案为:-78.64KJmol-1
(3)恒温恒容时,开始为1molSO2和2molO2 与开始为1molSO2和1molO2 相比,增大氧气的浓度,平衡正向移动,所以开始为1molSO2和2molO2 的SO2转化率高,放出热量的数值比|△H2|大,故答案为:大
(4)反应最后得到硫酸钠,根据钠原子、硫原子原子守恒,n(NaOH) = 2n(S) = 2×(0.2 + 0.8)mol = 2mol,若发生氧化还原反应,则是SO2被O2氧化,离子方程式为2SO2 + O2 + 4OH-═2SO42- + 2H2O,故答案为:2mol;2SO2 + O2 + 4OH-═2SO42- + 2H2O;
(5)恒温恒容,甲与乙起始n(SO2):n(O2)=2:1,甲等效为在乙的基础上增大一倍压强,平衡向正反应移动,转化率增大;丙按化学计量数转化到左边可得n(SO2)=2mol,n(O2)=1mol,与甲为等效平衡,平衡时对应个组分的物质的量相等。A、甲与丙为等效平衡,平衡时对应各组分的物质的量相等,故压强P甲=P丙,甲等效为在乙的基础上增大一倍压强,平衡向正反应移动,故P乙<P甲<2P乙,故P甲=P丙<2P乙,故A错误;B、甲与丙为等效平衡,平衡时对应各组分的物质的量相等,故质量m甲=m丙,甲等效为在乙到达平衡的基础上,再加入1mol SO2和0.5mol O2,增大压强,平衡向正反应移动,SO2转化率增大,m甲>2m乙,故m甲=m丙>2m乙,故B正确;C、对于甲、乙,SO2、O2起始物质的量之比等于化学计量数之比,c(SO2)与c(O2)之比为定值2:1,丙为分解反应,丙中c(SO2)与c(O2)之比为2:1,故k甲=k丙=k乙=2,故C错误;D、甲与丙为等效平衡,平衡时对应各组分的物质的量相等,故Q甲+Q丙=197,甲等效为在乙的基础上增大一倍压强,平衡向正反应移动,SO2转化率增大,故Q甲>2Q乙,故D错误;故选B;
(6)t2~t3段正逆速率都加快,且v(正)>v(逆),平衡正向移动.t4~t5段正逆速率都加快,且v(正)<v(逆),平衡逆向移动.该反应为体积减小的放热反应,若升高温度,平衡逆向移动,若增大压强,平衡正向移动,故t2~t3段为增大压强,t4~t5段为升高温度;t2~t3段为增大压强后,平衡正向移动,SO3的含量升高,至t3~t4平衡时含量达最高,故答案为:升高温度;t3~t4;
(7)由(6)的分析可知t2~t3段为增大压强,则K2=K1;t4~t5段为升高温度,则K3<K2;所以K4=K3<K2=K1;故答案为:K4=K3<K2=K1。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、W为六种前四周期元素,它们的原子序数依次增大。A与D同主族,可形成DA型离子化合物,B与C同周期且相邻,C与E同主族,E2-与Ar原子具有相同的电子层结构,W的合金用量最大、用途最广。请回答下列问题:
(1)W元素在元素周期表中的位置为 。
(2)下列说法正确的是( )
A.原子半径:A<B<C<D<E
B.D2WC4可以用来做消毒剂和净水剂
C.A4B2C3中既含有离子键又含有共价键
D.D2C2与EC2可以反应生成D2EC3和C2
(3)灼热的碳能与B的最高价氧化物对应水化物的浓溶液反应,化学反应方程式为 。
(4)向盛有A2C2溶液的试管中加入几滴酸化的WEC4溶液,溶液变成棕黄色,发生反应的离子方程式为 ;一段时间后,溶液中有大量气泡出现,随后溶液温度升高,有红褐色沉淀生成,则产生气泡的原因是 ;生成沉淀的原因是 (用平衡移动原理解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A.已知2SO2(g)+O2(g) ![]() 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则任何酸碱中和反应的热效应均为57.3 kJ
D.已知2C(s)+2O2(g)=2CO2(g) ΔH1,2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在FeCl3和CuCl2的混和溶液中,加入过量Fe粉,完全反应后,余下固体的质量与所加Fe粉质量相等,则原混和液中FeCl3和CuCl2的物质的量浓度之比为( )
A.7:2 B.2:7 C.1:2 D.2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如右图装置。下列叙述不正确的是( )

A、a和b分别与电源的负极正极相连时,电解氯化钠溶液产生氯气。
B、a和b用导线连接时,碳棒上发生的反应为:O2+2H2O+4e-=4OH-
C、若往溶液中加少许硫酸,无论a和b是否连接,铁片均会溶解,溶液逐渐变成浅绿色
D、若氯化钠溶液改为氯化铵溶液,a和b连接,碳棒上有气泡产生。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸正丁酯是无色透明有愉快果香气味的液体,可由乙酸和正丁醇制备。反应的化学方程式如下:![]()
发生的副反应如下:
有关化合物的物理性质见下表:
化合物 | 密度(g·cm-3) | 水溶性 | 沸点(℃) |
冰乙酸 | 1.05 | 易溶 | 118.1 |
正丁醇 | 0.80 | 微溶 | 117.2 |
正丁醚 | 0.77 | 不溶 | 142.0 |
乙酸正丁酯 | 0.90 | 微溶 | 126.5 |
已知:乙酸正丁酯、正丁醇和水组成三元共沸物恒沸点为90.7℃。
合成:
方案甲:采用装置甲(分水器预先加入水,使水面略低于分水器的支管口),在干燥的50mL圆底烧瓶中,加入11.5mL(0.125mol)正丁醇和7.2mL(0.125mol)冰醋酸,再加入3~4滴浓硫酸和2g沸石,摇匀。按下图安装好带分水器的回流反应装置,通冷却水,圆底烧瓶在电热套上加热煮沸。在反应过程中,通过分水器下部的旋塞分出生成的水(注意保持分水器中水层液面仍保持原来高度,使油层尽量回到圆底烧瓶中)。反应基本完成后,停止加热。
方案乙:采用装置乙,加料方式与方案甲相同。加热回流,反应60min后停止加热。

提纯:甲乙两方案均采用蒸馏方法。操作如下:

请回答:
(1)a处水流方向是 (填“进水”或“出水”),仪器b的名称 。
(2)合成步骤中,方案甲监控酯化反应已基本完成的标志是 。
(3)提纯过程中,步骤②是为了除去有机层中残留的酸,检验有机层已呈中性的操作是 ;步骤③的目的是 。
(4)下列有关洗涤过程中分液漏斗的使用正确的是 。
A.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞芯处不漏水即可使用
B.洗涤时振摇放气操作应如图所示
C.放出下层液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
D.洗涤完成后,先放出下层液体,然后继续从下口放出有机层置于干燥的锥形瓶中

(5)按装置丙蒸馏,最后圆底烧瓶中残留的液体主要是 ;若按图丁放置温度计,则收集到的产品馏分中还含有 。
(6)实验结果表明方案甲的产率较高,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用N2和H2可以实现NH3的工业和成,而氨又可以进一步制备硝酸。已知:
①N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
②N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
③2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
氨催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为 。
(2)研究在其他条件不变时,改变起始物氢气的物质的量对N2(g)+3H2(g)![]() 2NH3(g)反应的影响实验结果如图所示(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响实验结果如图所示(图中T表示温度,n表示物质的量):

图像中T2和T1的关系是:T2 T1(填“高于”“低于”“等于”“无法确定”)。
a、b、c三点中,N2转化率最高的是 (填字母)。
若容器容积为1L,T2℃在起始体系中加入1molN2,n(H2)=3mol,经过5min反应达到平衡时H2的转化率为60%,则v(NH3)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把温度为20℃,浓度为1.0mol·L-1的H2SO4和2.2mol·L-1的碱溶液各50ml混合(溶液密度均为1g·ml-1,比热容为4.184kJ·K-1·kg-1),轻轻搅动。测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1℃ | 终止温度t2℃ |
H2SO4+NaOH | 20 | 33.6 |
H2SO4+NH3·H2O | 20 | 32.6 |
则反应NH3·H2O=NH4++OH-的焓变约为(单位:kJ·mol-1)
A.2.1 B.4.2 C.52.7 D.缺少数据无法计算
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com