
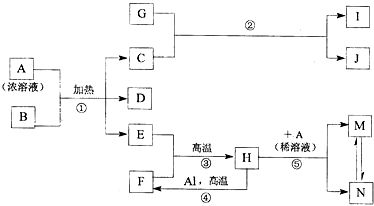
 ,化合物J的俗名纯碱.
,化合物J的俗名纯碱.分析 B为黑色的非金属单质,应为C,D可使品红溶液褪色,应为SO2,则A为H2SO4,E在通常状况下是无色无味液体,应为H2O,则C为CO2,G是淡黄色的固体化合物,应为Na2O2,则I、J应为Na2CO3和O2,I在通常状况下是无色气体,I为O2,J为Na2SO4,H是黑色晶体,反应④为铝热反应,则F为Fe,H为Fe3O4,与稀硫酸反应生成硫酸铁和硫酸亚铁,结合对应单质、化合物的性质解答该题.
解答 解:B为黑色的非金属单质,应为C,D可使品红溶液褪色,应为SO2,则A为H2SO4,E在通常状况下是无色无味液体,应为H2O,则C为CO2,G是淡黄色的固体化合物,应为Na2O2,则I、J应为Na2CO3和O2,I在通常状况下是无色气体,I为O2,J为Na2SO4,H是黑色晶体,反应④为铝热反应,则F为Fe,H为Fe3O4,与稀硫酸反应生成硫酸铁和硫酸亚铁,
(1)由以上分析可知F为Fe,位于周期表第四周期第Ⅷ族,G为Na2O2,电子式为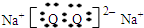 ,J应为Na2CO3和O2,J的俗名为纯碱,
,J应为Na2CO3和O2,J的俗名为纯碱,
故答案为:第四周期第Ⅷ族;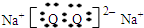 ;纯碱;
;纯碱;
(2)H为Fe3O4,金属Al和H的混合物俗称为铝热剂,
故答案为:铝热剂;
(3)镁条能在CO2中燃烧得到两种固体,其化学式分别是MgO、C,
故答案为:MgO、C;
(4)反应①为C和浓硫酸在加热条件下发生氧化还原反应,反应的化学方程式为C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,反应③为Fe和水蒸气在高温下反应生成Fe3O4和H2,反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2,
故答案为:C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2;
(5)M、N混合液中含有Fe3+,具有强氧化性,可与H2S发生氧化还原反应,反应的离子方程式为2Fe3++H2S═2Fe2++S↓+2H+,
故答案为:2Fe3++H2S═2Fe2++S↓+2H+.
点评 本题考查无机物的推断,题目难度中等,本题注意把握题给信息,结合物质的特性进行推断,为正确推断物质的种类为解答该题的关键,注意相关反应的化学方程式的书写,为易错点,注意体会.


科目:高中化学 来源: 题型:解答题
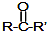 $→_{②H_{2}O/H+}^{①HCN/OH-}$
$→_{②H_{2}O/H+}^{①HCN/OH-}$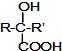
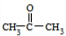 .
.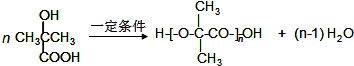 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200 g 63%的浓硝酸中含氧原子个数为6NA | |
| B. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 若CH3COONa溶液中CH3COO-的数目为6NA,则Na+的数目大于6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电负性较大的元素在化合物中只能形成负价,不能形成正价 | |
| B. | 若元素X的第一电离能比元素Y的第一电离能小,则X的金属活动性不一定强于Y | |
| C. | H元素与F元素的电负性差值达1.9,所以HF属于离子化合物 | |
| D. | 某元素原子外围电子排布式为3d64s2,则此元素可能易显+2和+3价,且+3价稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇、乙醇、氨气等都是重要的化工原料.
甲醇、乙醇、氨气等都是重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的O2和O3在相同条件下所占的体积相同 | |
| B. | 电解精炼铜时,若转移6.02×1023个电子,则阳极溶解32g铜 | |
| C. | 1molCl2溶于足量水中,转移的电子数为NA | |
| D. | 2L 0.2mol•L-1硝酸与适量铁恰好完全反应(还原产物为NO),生成NO的分子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
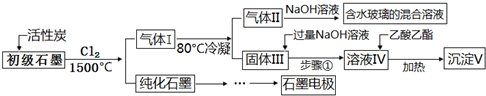
| A. | 向反应器中通入Cl2前,需通一段时间N2,主要目的是排除空气,减少碳的损失 | |
| B. | 在1500℃高温条件下,反应后初级石墨中的氧化物杂质均转变为相应的氯化物和CO2 | |
| C. | 步骤①为:搅拌、过滤,所得溶液IV中的阴离子有Cl-、OH-、AlO2? | |
| D. | 100 g初级石墨最多可获得V的质量为7.8 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com