
����Ŀ���о���ѧ��Ӧʱ����Ҫ�������ʱ仯�������仯��ҲҪ��ע��Ӧ�Ŀ������ȡ��ش���������:
(1)ij�¶�ʱ����2 L������A��B�������ʼ��ת����Ӧ�У�A��B���ʵ�����ʱ��仯����������ͼ��ʾ����ͼ�����ݷ����ã�(A��B��Ϊ����)
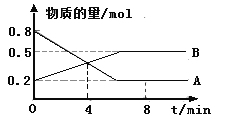
�ٸ÷�Ӧ�Ļ�ѧ����ʽΪ____________________��
�ڷ�Ӧ��ʼ��4 minʱ��B��ƽ����Ӧ����Ϊ________ ��
��4 minʱ����Ӧ�Ƿ�ﵽƽ��״̬��________(����������������)��8 minʱ��v(��)________v(��)(������������������������)��
(2)�̶�������CO2����Ч��������Դ�������ٿ����е��������塣��ҵ����һ����CO2�������״�ȼ�ϵķ�����CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)��ij��ѧʵ�齫6molCO2��8molH2����2L���ܱ������У����H2�����ʵ�����ʱ��仯��ͼ���ߢ���ʾ��a��b��c��d��e���������ݱ�ʾ���꣮
CH3OH(g)+H2O(g)��ij��ѧʵ�齫6molCO2��8molH2����2L���ܱ������У����H2�����ʵ�����ʱ��仯��ͼ���ߢ���ʾ��a��b��c��d��e���������ݱ�ʾ���꣮
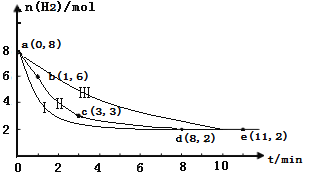
��a��b��b��c��c��d��d��e�Ķ��У�ƽ����Ӧ��������ʱ�����___________ ����ʱ�����CO2��ƽ����Ӧ������________��
�����ڷ�Ӧ�м����˴�������Ӧ���̽���Ϊͼ�е�����_____ (������������������������)��
��ƽ��ʱCO2��ת������_________����Ӧǰ�������ڵ�ѹǿ����__________��
���𰸡�2A(g)![]() B(g) 0.025mol/(Lmin) �� �� a��b 1/3mol/(L min) �� 33% 7:5
B(g) 0.025mol/(Lmin) �� �� a��b 1/3mol/(L min) �� 33% 7:5
��������
����ͼ�����ݼ���Ӧ����ʽ���㷴Ӧ���ʣ�����ͼ�����ݷ����Ƿ�ﵽƽ��״̬������ת���ʵ���ؼ��㡣
(1)����ͼ��֪��ͬʱ���ڣ�A���ʵ�������0.6mol��B���ʵ�������0.3mol�����Ը÷�Ӧ�Ļ�ѧ����ʽΪ2A(g)![]() B(g)��
B(g)��
�ڸ���ͼ�еı�����ϵ��֪����Ӧ��ʼ��4 minʱ��n(B)=0.4mol����v(B)=![]() ��
��
����ͼʾ֪4 minʱ����Ӧ������������ʵ������ڱ仯�����Է�Ӧû�дﵽƽ��״̬��8 minʱ����Ӧ������������ʵ������ٱ仯����Ӧ�ﵽƽ��״̬������v(��)=v(��)��
(2)����ͼ��ʾ���տ�ʼʱ����Ӧ���Ũ�ȴ�����ƽ����Ӧ��������ʱ�����a��b��v(H2)=![]() ����v(CO2)=1/3v(H2)=1/3��1mol/(L min)=1/3mol/(L min)��
����v(CO2)=1/3v(H2)=1/3��1mol/(L min)=1/3mol/(L min)��
�ڷ�Ӧ�м����˴�������Ӧ���ʼӿ죬����ƽ�����õ�ʱ����٣���ƽ��״̬��ͬ����Ӧ���̽���Ϊͼ�е���������
����ͼ��ʾƽ��ʱn(H2)=2mol����Ӧ���ĵ�����Ϊ 8mol-2mol=6mol�����ĵĶ�����̼Ϊ 6mol��1/3=2mol����ƽ��ʱCO2��ת������![]() =33%��ƽ��ʱ���ɵ� CH3OH��H2O���ʵ����ֱ�Ϊ��6mol��1/3=2mol����Ӧǰ�������ڵ�ѹǿ�ȵ��ڷ�Ӧǰ���������ʵ���֮�ȣ�
=33%��ƽ��ʱ���ɵ� CH3OH��H2O���ʵ����ֱ�Ϊ��6mol��1/3=2mol����Ӧǰ�������ڵ�ѹǿ�ȵ��ڷ�Ӧǰ���������ʵ���֮�ȣ�![]() 7:5���ʴ�Ϊ��a��b��1/3mol/(L min)������33%��7:5��
7:5���ʴ�Ϊ��a��b��1/3mol/(L min)������33%��7:5��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��Z�����ֶ���������Ԫ�أ���ԭ�Ӱ뾶��ԭ�������ı仯��ͼ����֪W�ǵؿ��к�����ߵ�Ԫ�أ�X��Neԭ�ӵĺ�����������1��Y�ĵ�����һ�ֳ����İ뵼����ϣ�Z�ķǽ�������ͬ����Ԫ������ǿ������˵������ȷ����
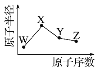
A. ��Ӧ�ļ����ӵİ뾶��X��W
B. ��Ӧ�ļ���̬�⻯����ȶ��ԣ�Y��Z
C. Ԫ��X��Z�ֱ���W���γɶ��ֻ�����
D. Z������������Ӧ��ˮ�������ǿ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������������ѣ�CH3OCH3��ֱ��ȼ�ϵ�������������졢�����ܶȸߡ�Ч�ʺõ��ŵ㣬����ԭ����ͼ��ʾ�������йظõ�ص�˵������ȷ����
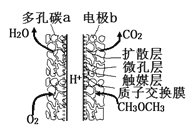
A. ���̼a���������̽Ӵ��������߷�Ӧ���ʣ��õ缫Ϊ����
B. �缫b�Ϸ����ķ�ӦΪ��CH3OCH3-12e-+3H2O=2CO2+12H+
C. H+��b�缫��a�缫Ǩ��
D. ������ֱ��ȼ�ϵ�������ܶ�( kW��h��kg��1)ԼΪ�״���CH3OH��ֱ��ȼ�ϵ�������ܶȵ�1.4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ũ��ˮ����ܵ��Ƿ�©��,��Ӧ��ѧ����ʽΪ:3Cl2+8NH3=6NH4Cl+N2,����10.65gCl2����ʱ,�������İ������ʵ���Ϊ
A. 0.1mol B 0.2 mol C. 0.3mol D.0.4mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2H4��H2O��ˮ���£������Ҳ��ȶ���100�������ֽ�ʧˮ����������ԭ���ͳ�������ͨ������N2��H2O�������۵�Ϊ��40�棬�е�118.5�档����Cl2��NaOH��(NH2)2CO�����أ���SO2Ϊԭ�Ͽ��Ʊ�N2H4��H2O����ˮNa2SO3������Ҫ�������£�
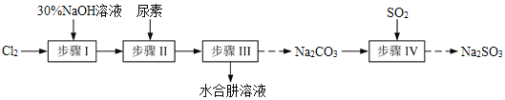
��֪��Cl2(g)��2OH-(aq)=ClO-(aq)��Cl-(aq)��H2O(aq) ��H<0
��1������30%NaOH��Һʱ�����貣����������Ͳ���ձ��⣬����Ҫ_____________�����ţ���
A������ƿ B����ͷ�ι� C�������� D����ƿ
��2��������Ʊ�NaClO��Һʱ�����¶ȳ���40�棬Cl2��NaOH��Һ��ַ�Ӧ����NaClO3��NaCl��ʵ����Ϊ���Ʒ�Ӧ�¶ȳ����ñ�ˮԡ����ֽ����⣬�����ȡ�Ĵ�ʩ��_______________________��
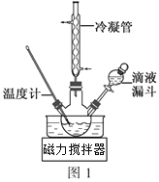
��3�������ϳ�N2H4��H2O��װ����ͼ1��ʾ��NaClO������Һ������ˮ��Һ��40�����·�Ӧһ��ʱ�����Ѹ��������110�������Ӧ��ʵ����ͨ����Һ©���μӵ���Һ��_____________������ĸ����
a��������Һ b��NaClO������Һ c��������Һ��NaClO��Һ��ѡ��һ
������____________________________________��
��4��������з����N2H4��H2OӦ�ò��õķ����������____________________��
��5��������ò����õ��ĸ���ƷNa2CO3�Ʊ���ˮNa2SO3��ˮ��Һ��H2SO3��HSO3-��SO32-��pH�ķֲ���ͼ2��ʾ��Na2SO3���ܽ��������ͼ3��ʾ����
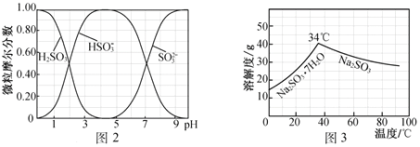
�ٱ߽������Na2CO3��Һ��ͨ��SO2�Ʊ�NaHSO3��Һ��ʵ����ȷ����ʱֹͣͨSO2�ķ�����______________��
���벹��������NaHSO3��Һ�Ʊ���ˮNa2SO3��ʵ�鷽����_________________________________����������ˮ�Ҵ�ϴ�ӣ�����ܷ��װ��
��6����ҵ�ϻ�������ˮ���»�ԭ����ȡ�⻯�ƣ�����������ͼ��
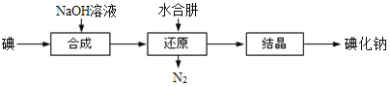
��ԭ�����п������ƻ���м���������ˮ���£���ˮ���»�ԭ���ƵõIJ�Ʒ���ȸ��ߣ�ԭ����_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
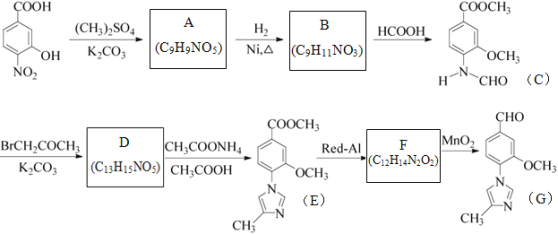
����Ŀ����������G��һ�����ںϳ���-���ڵ��ڼ���ҩ���м��壬��ϳ�·������ͼ���£�
��֪��![]()
��ش�
��1��B�Ľṹ��ʽΪ___________________��
��2������˵����ȷ����__________________��
A��������A����FeCl3��Һ������ɫ��Ӧ
B��1mol������C�������2molNaOH��Ӧ
C��������E���������ԣ����л�ԭ��
D�������̿�֪��Red-Al��MnO2�ֱ�����ԭ����������������MnO2Ҳ����Cu/O2�����������Ը�����صȴ���
E��������G�����ʽΪC6H6NO
��3��C��D�Ĺ�������һ����ɫ��ζ����������仯ѧ����ʽΪ____________________��
��4��д��ͬʱ��������������B��ͬ���칹��Ľṹ��ʽ____________________��
�ٺ��б������ҷ�������һ������̼ԭ�ӣ�
���ܷ���ˮ�ⷴӦ��ˮ�����֮һ�Ǧ�-�����ᣬ��һˮ����������ֻ��2�ֲ�ͬ��ѧ�������⡣
��5����֪��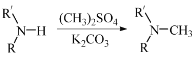 (R����������R'����������H)����д����
(R����������R'����������H)�������![]() ��
��![]() ��(CH3)2SO4Ϊԭ���Ʊ�
��(CH3)2SO4Ϊԭ���Ʊ�![]() �ĺϳ�·������ͼ(���Լ����ã��ϳ�·������ͼʾ�����������) _________��
�ĺϳ�·������ͼ(���Լ����ã��ϳ�·������ͼʾ�����������) _________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧѧϰ�г������Ʒ���������������ȷ����![]() ����
����![]()
A. ![]() Ϊֱ���η��ӣ�
Ϊֱ���η��ӣ�![]() ҲΪֱ���η���
ҲΪֱ���η���
B. ��̬![]() �Ƿ��Ӿ��壬��̬
�Ƿ��Ӿ��壬��̬![]() Ҳ�Ƿ��Ӿ���
Ҳ�Ƿ��Ӿ���
C. ![]() ��Nԭ����
��Nԭ����![]() �ӻ���
�ӻ���![]() ��Bԭ��Ҳ��
��Bԭ��Ҳ��![]() �ӻ�
�ӻ�
D. ![]() ������NaOH��Һ��
������NaOH��Һ��![]() Ҳ������NaOH��Һ
Ҳ������NaOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���绯ѧ���������������ڼ�����NH3�ĺ������乤��ԭ����ͼ��ʾ��NH3������Ϊ���������ʣ�����˵��������ǣ��� ����

A. ��Һ��K+��缫b�ƶ�
B. ��Ӧ���ĵ�NH3��O2�����ʵ���֮��Ϊ4��5
C. �����ڵ缫a�Ϸ���������Ӧ
D. �����ĵ缫��ӦʽΪ��O2+4e��+2H20=4OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����淴Ӧ2NO2(g) ![]() 2NO(g)��O2(g)������̶����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־�� �ٵ�λʱ��������nmolO2��ͬʱ����2nmolNO2���ڵ�λʱ��������nmolO2��ͬʱ����2nmolNO������NO2��NO��O2�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���ʵı�Ϊ2��2��1���ܻ�������ѹǿ���ٸı䣻�ݻ���������ɫ���ٸı䣻��������ƽ����Է����������ٸı䡣
2NO(g)��O2(g)������̶����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־�� �ٵ�λʱ��������nmolO2��ͬʱ����2nmolNO2���ڵ�λʱ��������nmolO2��ͬʱ����2nmolNO������NO2��NO��O2�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���ʵı�Ϊ2��2��1���ܻ�������ѹǿ���ٸı䣻�ݻ���������ɫ���ٸı䣻��������ƽ����Է����������ٸı䡣
A. �٢ܢݢ� B. �٢ۢܢ� C. �٢ڢۢ� D. �ڢݢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com