
【题目】在25 ℃时,将1.0L c molL-1CH3COOH溶液与0.1molNaOH固体混合,使之充分反应。然后向该混合溶液中加入少量CH3COOH或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。下列叙述错误的是

A. 水的电离程度:c>b>a
B. a点对应的混合溶液中,c(CH3COOH)>c(Na+ )>c(OH-)
C. 当混合溶液呈中性时,c(Na+ )=c(CH3COO-)>c(H+) =c(OH-)
D. 该温度下,醋酸的电离平衡常数![]()
【答案】D
【解析】A项,由图可得,25℃时c点pH=7,所以c点水电离的c(H+)水=c(OH-)水=10-7mol/L,b点pH=4.3,所以b点溶液中c(H+)=10-4.3 mol/L,则由水电离出的c(H+)水=c(OH-)水=10-(14-4.3)mol/L=10-9.7mol/L,a点pH=3.1,所以a点溶液中c(H+)=10-3.1 mol/L,则由水电离出的c(H+)水=c(OH-)水=10-(14-3.1)mol/L=10-10.9mol/L,因此水的电离程度:c>b>a,故A正确;B项,b点时溶液呈酸性,说明加入0.1molNaOH固体后CH3COOH有剩余,c(Na+)=0.1mol/L,混合前CH3COOH溶液浓度c应比0.1mol/L大,a点时又加入0.1molCH3COOH,因为CH3COOH电离程度很小,所以此时溶液中的c(CH3COOH)一定大于c(Na+),又根据前面的分析a点c(OH-)=10-10.9mol/L,所以a点对应的混合溶液中,c(CH3COOH)>c(Na+)>c(OH-),故B正确;C项,由题意混合溶液中阳离子有Na+和H+,阴离子有CH3COO-和OH-,根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),25℃当混合溶液呈中性时,c(H+)=c(OH-)=10-7mol/L,则c(Na+)=c(CH3COO-),由已知及图像可得c(Na+)=0.2mol/L,所以c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故C正确;D项,由前面的分析并结合图像可得,25℃当混合溶液呈中性时,c(H+)=10-7mol/L,c(CH3COO-)=0.2mol/L,c(CH3COOH)=(c+0.1-0.2)mol/L=(c-0.1)mol/L,所以该温度下,醋酸的电离平衡常数Ka=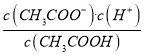 =
=![]() ,故D错误。
,故D错误。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】以铝土矿(主要成分为Al2O3和杂质)为原料制备铝的一种工艺流程如下:

注:反应Ⅰ“碱溶”时杂质转化为沉淀
(1)反应Ⅰ,发生反应生成偏铝酸钠的离子方程式__________。
(2)电解Ⅰ是电解熔融的冰晶石和Al2O3的混合物,电解过程中作阳极的石墨易消耗,原因是___________。
(3)反应Ⅱ,用一定浓度的NaHCO3溶液处理过滤Ⅰ后的滤液,所得溶液pH和生成Al(OH)3的量随加入NaHCO3溶液体积变化的曲线如下:

①加入NaHCO3溶液体积小于8 mL时,发生主要反应的离子方程式__________。
②反应Ⅱ中生成Al(OH)3的离子方程式__________。
(4)电解Ⅱ是电解Na2CO3溶液,得到含NaHCO3的阳极液,原理如下图所示。

阴极产生的物质A的化学式为____________。
(5)以铝材为阳极,在H2SO4溶液中电解,可在铝材表面形成致密氧化膜,阳极电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
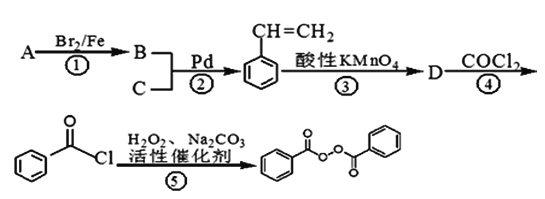
【题目】C14H10O4常用的油脂、蜡的漂白剂、化妆品助剂、橡胶硫化剂。下面是以物质A为原料合成C14H10O4的流程:
提示:①2010年赫克、根岸英一和铃木章因在“钯催化交叉偶联反应”研究领域作出了杰出贡献,而获得了诺贝尔化学奖,其反应机理可简单表示为: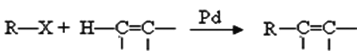
②苯乙烯和甲苯与酸性KMnO4溶液反应产物相同。
请回答下列问题:
(1)物质A的分子式为_________,物质C中含有的官能团的名称为________,D的结构简式为___________;
(2)反应①~④中属于取代反应的有________________;
(3)反应②的化学反应方程式___________________________________;
(4)某物质E为漂白剂(C14H10O4,)的同分异构体,同时符合下列条件的E的同分异构体有___种;
①含有联苯结构单元(![]() ),在一定条件下能发生银镜反应,且1molE最多可消耗4mol NaOH
),在一定条件下能发生银镜反应,且1molE最多可消耗4mol NaOH
②遇FeCl3溶液不显紫色,且苯环上核磁共振氢谱有六个吸收峰.
(5)请写出以苯乙烯和乙烯为原料,合成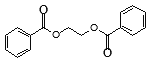 的流程,无机物任选,注明反应条件_____________。
的流程,无机物任选,注明反应条件_____________。
示例如下: 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在原电池中,通常较活泼的金属做_____极,发生_______反应;
电解池中,与电源正极相连的极是_______极,发生________反应。
(2)下图所示水槽中试管内有一枚铁钉,放置数天后观察:
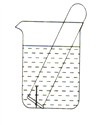
①若试管内液面上升,发生_____腐蚀,正极反应式为________________。
②若试管内液面下降,发生_______腐蚀,正极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用硫酸分解磷尾矿[主要成份为Ca5(PO4)3F]可制得中强酸磷酸H3PO4。请回答:
①Na2HPO4溶液呈碱性,则在该溶液中c(H2PO4-)_____c(PO43-)(填“>”、“<”、“=”),
向Na2HPO4溶液中加入足量的CaCl2溶液,溶液显酸性,溶液显酸性的原因是(从电离平衡移动角度分析):_____________________________。
②已知:25℃时,H3PO4的电离平衡常数:K1=7.52×10-3;K2=6.23×10-8;K3=6.23×10-13则:H3PO4(aq)+OH-(aq)![]() H2PO4-(aq)+H2O (l)的平衡常数K=______。
H2PO4-(aq)+H2O (l)的平衡常数K=______。
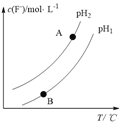
③Ca5(PO4)3F(s) +OH-(aq)![]() Ca5(PO4)3(OH) (s)+F-,该温度下,溶液中c(F-)随溶液的pH和温度(T)的变化曲线如右图所示。则:pH1___pH2(填“>”、“<”、“=”);A、B两点的溶液中F-的速率v(A)____v(B)(填“>”、 “<”、“=”)。
Ca5(PO4)3(OH) (s)+F-,该温度下,溶液中c(F-)随溶液的pH和温度(T)的变化曲线如右图所示。则:pH1___pH2(填“>”、“<”、“=”);A、B两点的溶液中F-的速率v(A)____v(B)(填“>”、 “<”、“=”)。
(2)处理含镍酸性废水可用电解法实现铁上镀镍,其装置如右图所示。
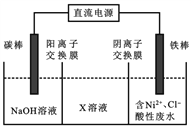
①电流方向是_____(填:a.碳棒→铁棒;b.铁棒→碳棒);
②中间隔室的可以得到的物质X是_______(填化学式);
③阳极的电极反应式为_______________;电解总反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类正确的是( )
选项 | 碱 | 酸 | 盐 | 酸性氧化物 |
A | 苏打 | 硫酸 | 小苏打 | 二氧化硫 |
B | 苛性钠 | 碳酸 | 胆矾 | 一氧化氮 |
C | 烧碱 | 硝酸 | 石灰石 | 二氧化硅 |
D | 纯碱 | 醋酸 | 碘化钾 | 一氧化碳 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com