

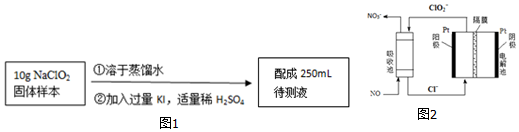
���� ��ʵ�������Ⱦ�����壬ֱ���ŷŻ���Ⱦ����������Ҫβ��������װ�âپ����ü����շ�Ӧ������ClO2��β�����ر�K1��װ�â��з�����Ӧ��2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O������ClO2���壬ClO2���徭װ�â۽���װ�âܣ�������Ӧ��2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2����NaClO2��Һ���������ᾧ�����ˡ�ϴ�ӡ�����Ȳ������þ���NaClO2•3H2O��
��1��װ�â۵������Ƿ�ֹ������
��2��װ�â�Ϊ����������������⡢�������Ʒ�Ӧ�Ʊ���NaClO2��Ӧ��
��3����ΪNaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO2•3H2O������38��ʱ����������NaClO2������60��ʱNaClO2�ֽ��NaClO3��NaCl����Ҫ�õ�NaClO2���壬����38-60��õ����壬����38-60�����ˮϴ�ӣ�
��4���õ�����Һ��ָʾ�����÷�Ӧ��Na2S2O3��Һ�ζ��⣬�յ���Һ����ɫ��Ϊ��ɫ�Ұ�����ڲ���ɫ��
��5�����ݻ�ѧ��Ӧ�ɵù�ϵʽ��NaClO2��2I2��4S2O32-������Ʒ��NaClO2�����ʵ���x�����ݹ�ϵʽ���㣻
��6����������������Ӧ���������ӣ�ʧ���ӣ�����ClO2-��
��7��ClO2-��һ����������������ԭ��Ӧ��������������ӣ�
��� �⣺��1��װ�â۵������Ƿ�ֹ������
�ʴ�Ϊ����ֹ������
��2��װ�â�Ϊ����������������⡢�������Ʒ�Ӧ�Ʊ���NaClO2��Ӧ����Ԫ�ػ��ϼ۽��ͣ��������������Ԫ�ػ��ϼ������������������ӷ���ʽΪ��2OH-+2ClO2+H2O2=2ClO2-+2H2O+O2����
�ʴ�Ϊ��2OH-+2ClO2+H2O2=2ClO2-+2H2O+O2����
��3�������֪��NaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO2•3H2O������38��ʱ����������NaClO2������60��ʱNaClO2�ֽ��NaClO3��NaCl����Ҫ�õ�NaClO2���壬����38-60��õ����壬����38-60�����ˮϴ�ӣ�
�ʴ�Ϊ����38�桫60�����ˮϴ�ӣ�
��4���õ�����Һ��ָʾ�����÷�Ӧ��Na2S2O3��Һ�ζ��⣬�������һ��Na2S2O3��Һ���յ���Һ����ɫ��Ϊ��ɫ�Ұ�����ڲ���ɫ��
�ʴ�Ϊ����Һ����ɫ��Ϊ��ɫ�Ұ���Ӳ���ɫ��
��5����25.00mL������Һ��NaClO2�����ʵ���x����
NaClO2��2I2��4S2O32-��
1mol 4mol
x 20��10-3��2mol
��ã�x=1��10-2mol��
m��NaClO2��=0.01mol��90.5g/mol=0.905g��
��mg��Ʒ��NaClO2����������Ϊ$\frac{0.905g��4}{mg}��100%$=$\frac{3.62}{m}��100%$��
�ʴ�Ϊ��=$\frac{3.62}{m}��100%$��
��6����������������Ӧ���������ӣ�ʧ���ӣ�����ClO2-���缫��ӦʽΪ��Cl-+4OH--4e-=ClO2-+H2O��
�ʴ�Ϊ��Cl-+4OH--4e-=ClO2-+H2O��
��7��ClO2-��һ����������������ԭ��Ӧ��������������ӣ����ӷ���ʽΪ��4NO+3ClO2-+4OH-=4NO3-+3Cl-+2H2O��
�ʴ�Ϊ��4NO+3ClO2-+4OH-=4NO3-+3Cl-+2H2O��
���� �����������Ʊ�Ϊ���壬����ѧ����ԭ���ķ������⡢���ʵķ����ᴿ��������ԭ��Ӧ�����ʺ����ⶨ�����ԭ���ȣ���Ҫѧ���߱���ʵ�Ļ�������Ŀ�Ѷ��еȣ�


 �ܿ�����ĩ��̾�ϵ�д�
�ܿ�����ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
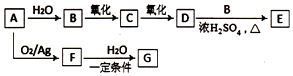 A��һ����Ҫ�Ļ���ԭ�ϣ�C��F�ķ���ʽ��ΪC2H4O��F��û�в����ͼ��Ļ�״�л��G�ķ���ʽΪC2H6O2��G�к���������ͬ�Ĺ����ţ�ת����ϵ��ͼ��
A��һ����Ҫ�Ļ���ԭ�ϣ�C��F�ķ���ʽ��ΪC2H4O��F��û�в����ͼ��Ļ�״�л��G�ķ���ʽΪC2H6O2��G�к���������ͬ�Ĺ����ţ�ת����ϵ��ͼ�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1 mol | B�� | 0.2 mol | C�� | 0.3 mol | D�� | 0.4 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
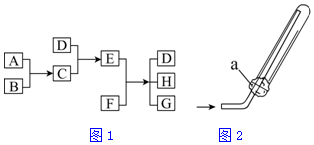 ��֪A��B��C��DΪ���壬E��FΪ���壬G���Ȼ��ƣ�����֮���ת����ϵ��ͼ1��ʾ��
��֪A��B��C��DΪ���壬E��FΪ���壬G���Ȼ��ƣ�����֮���ת����ϵ��ͼ1��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na2O2��Fe3O4��CuO��Ϊ���������� | B�� | ���ᡢˮ��������ˮ��Ϊ����� | ||
| C�� | �ռ�����ᡢ���Ȼ�̼��Ϊ����� | D�� | ϡ���������ᡢ�Ȼ�����Һ��Ϊ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | úȼ��ʱ��������CO2 | B�� | ú����ȫȼ�ղ�������CO | ||
| C�� | úȼ��ʱ��������SO2 | D�� | ��ҵ�������ŷŴ����̳� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
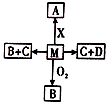 ��֪M��A��B��C��D��X�������ʶ�����ѧ��ѧ�ij������ʣ����ǵ�ת����ϵ����ͼ��ʾ��ijЩ��Ӧ����߷�Ӧ����û�б������
��֪M��A��B��C��D��X�������ʶ�����ѧ��ѧ�ij������ʣ����ǵ�ת����ϵ����ͼ��ʾ��ijЩ��Ӧ����߷�Ӧ����û�б�������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 4.0g �����к��е�����������Ϊ4NA | |
| B�� | 3.9g 2H37Cl�к��е�������Ϊ2.1NA | |
| C�� | ��״���£�11.2L�����к��еķǼ��Լ���ĿΪNA | |
| D�� | 100mL 1mol•L-1 CH3COOH��Һ�к��еķ�����Ŀ����0.1NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
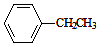 $��_{����}^{Fe_{2}O_{3}}$
$��_{����}^{Fe_{2}O_{3}}$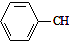 =CH2+H2������˵����ȷ���ǣ�������
=CH2+H2������˵����ȷ���ǣ�������| A�� | ���Ը��������Һ����ˮ���������������ұ��ͱ���ϩ | |
| B�� | �ұ�������ϩ���ܷ���ȡ����Ӧ���Ӿ۷�Ӧ��������Ӧ | |
| C�� | �ұ���һ��ȡ�������й���5�� | |
| D�� | �ұ��ͱ���ϩ�����ڹ�ƽ���̼ԭ��������Ϊ7 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com