
【题目】常温下在稀盐酸中插入一小块铜片,加入下列物质后,不能使铜片溶解的是
A. 浓硝酸 B. 硫酸钠晶体 C. 硝酸钾晶体 D. 氯化铁晶体
科目:高中化学 来源: 题型:
【题目】保护水资源刻不容缓。下列属于物理方法处理废水的是( )
A. 用生石灰处理酸性废水
B. 用沉淀剂处理含重金属离子的废水
C. 用稀盐酸处理碱性废水
D. 用沉降法处理废水中的固体颗粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2015·上海]工业上将Na2CO3和Na2S以1∶2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。在该反应中
A.硫元素既被氧化又被还原
B.氧化剂与还原剂的物质的量之比为1∶2
C.每生成1 mol Na2S2O3,转移4 mol电子
D.相同条件下,每吸收10 m3 SO2就会放出2.5 m3 CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中短周期的一部分如图所示,关于X、Y、Z、W、Q的说法正确的是

A.元素Y与元素Z的最高正化合价之和的数值等于9
B.原子半径的大小顺序为W>Z>Y
C.离子半径的大小顺序为W2->Y2->Z3+
D.W的气态氢化物的热稳定性和还原性均比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作的叙述错误的是
A.过滤操作中,漏斗的尖端应接触烧杯内壁
B.向容量瓶中转移液体时,引流用的玻璃棒可以接触容量瓶内壁
C.配制5%NaCl溶液时,必须用到的玻璃仪器是容量瓶、烧杯、胶头滴管、玻璃棒
D.分液漏斗、容量瓶及滴定管使用前都必须检漏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是
A. 溶液中![]() 不变
不变
B. 醋酸的电离程度增大,溶液中导电粒子的数目减少
C. 若稀释到pH=4,所需水的体积等于90mL
D. 再加入10mLpH=11的NaOH溶液,混合后溶液的pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下RO3—与R—发生如下反应:RO3—+5R—+6 H+=3R2+3H2O,则下列关于R元素的说法中正确的是:( )
A. R位于元素周期表中的第VA族 B. R的氢化物的水溶液呈酸性
C. RO3—中的R元素只能被还原 D. R2在常温常压下一定是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料。利用CO2和 H2在催化剂的作用下合成甲醇,有关反应的反应热与平衡常数表示如下:
反应1:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H1 K1
CO(g)+H2O(g) △H1 K1
反应2:CO(g)+2H2(g) ![]() CH3OH(g) △H2 K2
CH3OH(g) △H2 K2
总反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3 K3
CH3OH(g)+H2O(g) △H3 K3
(1)①△H3=_________(用△H1、△H2表示)。
②K3 =____________(用K1、K2表示)。
③在恒温恒容的密闭容器中,能判断总反应达平衡状态的依据是______(填番号)。
a.容器中的压强保持不变
b.H2的质量分数保持不变
c.有两个C=O键断裂的同时水分子中有两个H-O键断裂
d.化学平衡常数K保持不变
e.c(CO2) =c(H2O)
f.速率v (CO2) =v(H2O)
④在某温度下,反应体系达平衡时,增大体系的压强,体系中,反应1的平衡______移动(填“向正反应方向”、“向逆反应方向”和“不”)。
(2)以上平衡常数随温度变化的曲线如图所示:
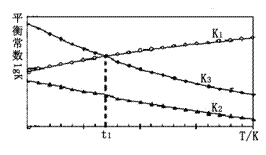
①则△H2_____△H3(填“大于”、“小于”或“等于”),理由是______________。
②温度为t1时,体系建立起化学平衡状态,测得c(H2)=0.1 mol·L-1 ,c(CH3OH):c(CO)=________。
(3)甲醇可用于制取氰化氢。已知:Ka(HCN) = 6.0×10-10,Kw=1×10-14氰化钠水解的离子方程式为CN-+H2O![]() HCN+OH-。
HCN+OH-。
①该水解反的平衡常数的值Kh=_________。
②一种由等物质的量浓度的NaCN和HCN组成的缓冲溶液,该溶液的pH____7 (“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com