
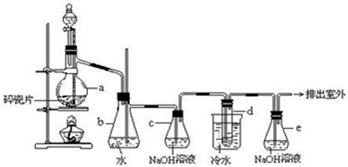
分析 实验原理:乙醇和浓硫酸反应主要生成乙烯气体,浓硫酸有强氧化性和脱水性,所以还可能混有碳和浓硫酸反应生成的CO2和SO2气体,b为安全瓶,c为净化除杂装置,d为乙烯和溴的反应装置,e为尾气吸收装置,
(1)实验室中用乙醇和浓硫酸在170℃来制取乙烯;
(2)乙烯和溴单质的加成反应来制得1,2-二溴乙烷;
(3)根据装置图可知,当d堵塞时,气体不畅通,则在b中气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管;
(4)根据上面的分析可知,乙烯中可能有CO2和SO2等酸性气体,对实验有干扰,所以要除去,C为净化装置;
(5)溴水有颜色,而1,2-二溴乙烷为无色;
(6)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离;
(7)溴易挥发,冷却防止溴大量挥发.
解答 解:实验原理:乙醇和浓硫酸反应主要生成乙烯气体,浓硫酸有强氧化性和脱水性,所以还可能混有碳和浓硫酸反应生成的CO2和SO2气体,b为安全瓶,c为净化除杂装置,d为乙烯和溴的反应装置,e为尾气吸收装置,
(1)实验室中用乙醇和浓硫酸在170℃来制取乙烯,反应的方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)乙烯和溴单质的加成反应来制得1,2-二溴乙烷,反应方程式为CH2=CH2+Br2→CH2BrCH2Br,
故答案为:CH2=CH2+Br2→CH2BrCH2Br;
(3)试管d发生堵塞时,b中压强不断增大,会导致b中水面下降,玻璃管中的水柱上升,甚至溢出,
故答案为:b中水面会下降,玻璃管中的水面会上升,甚至溢出;
(4)a中浓硫酸可以使部分乙醇脱水,生成碳,碳和浓硫酸反应生成H2O、CO2和SO2气体,混合气体通过c瓶,CO2和SO2气体被氢氧化钠吸收,
故答案为:除去乙烯中带出的酸性气体或答二氧化碳、二氧化硫;
(5)判断该制备反应已经结束的最简单方法是,乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,所以判断反应结束的方法是观察d中溴水完全褪色,
故答案为:溴水颜色基本褪去;
(6)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离,
故答案为:蒸馏;
(7)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,
故答案为:冷却可避免溴挥发.
点评 本题考查了制备实验方案的设计、溴乙烷的制取方法,题目难度不大,注意掌握溴乙烷的制取原理、反应装置选择及除杂、提纯方法是解题的关键,注重培养学生分析问题、解决问题的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:| 沸点/.c | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验:
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | |
| B. | 平衡向逆反应方向移动 | |
| C. | 平衡不移动,但容器内的压强将增大 | |
| D. | 平衡不移动,且容器内的压强不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
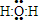 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不溶解时,可确定有Cl-存在 | |
| B. | 通入Cl2后,溶液变为深黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在 | |
| C. | 加入BaCl2溶液,生成白色沉淀,加稀硝酸后沉淀不溶解时,可确定有SO42-存在 | |
| D. | 加入NaOH溶液,加热,生成的气体能使干燥的红色石蕊试纸变蓝,可确定有NH4+存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度为0.5mol•L-1的MgCl2溶液中,含有Cl-个数为NA | |
| B. | 标准状况下,11.2LH2O所含的分子数为0.5NA | |
| C. | 常温常压下,1.06g Na2CO3含有的Na+数为0.02NA | |
| D. | 18g H2O和H2O2的混合物含有的分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com